
【题目】下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.苯和乙烯都能使溴水褪色,但褪色的原理是不同的
C.用溴水可以鉴别乙烯与乙炔
D.苯和苯的同系物都可以用酸性高锰酸钾溶液鉴别
科目:高中化学 来源: 题型:
【题目】碳是一种常见的元素,它以多种形式广泛存在于自然界之中。
(1)星际空间存在多种有机分子和无机分子,多数都含有碳元素,C2是一种星际分子,C2和C60互为_______________。
(2)CO2是碳元素重要的氧化物,回答下列有关问题:
①利用CO2与Na2O2反应,可向呼吸面具中提供氧气,其反应方程式为_________________。
②工业上可由CO2和NH3在一定条件下合成尿素,反应方程式为2NH3+CO2![]() CO(NH2)2+H2O当
CO(NH2)2+H2O当![]() 时,CO2的转化率随时间的变化关系如图所示.
时,CO2的转化率随时间的变化关系如图所示.
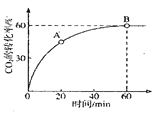
A点的逆反应速率![]() __________B点的正反应速率
__________B点的正反应速率![]() (填“大于“小于”或“等于”),NH3的平衡转化率为____________。
(填“大于“小于”或“等于”),NH3的平衡转化率为____________。
③随着对环境问题认识的深入,CO2的转化捕获问题已成为科研热点之一,以附着纳米银的惰性电极作阴极,可电解CO2转化为CO,装置示意图如下:
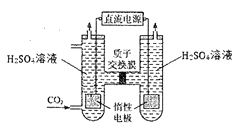
写出通CO2侧电极反应式_________________。
④CO2可用于生产碳酸饮料。苯甲酸钠(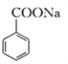 可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( ) 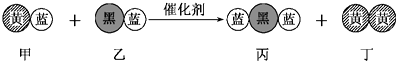
A.该反应属于氧化还原反应
B.甲和丙中同种元素化合价不可能相等
C.丁物质一定是非金属单质
D.配平后甲、乙、丙的化学计量数均为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:
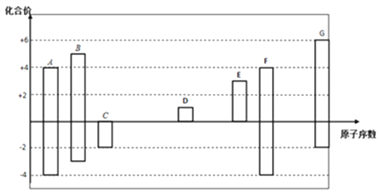
(1)元素A在周期表中的位置_________。
(2)用电子式表示D2G的形成过程_________________。
(3)C、D、G对应的简单离子半径大小顺序是__________(用离子符号回答)。
(4)某同学设计实验装置如图所示,证明A、B、F的非金属性强弱关系:
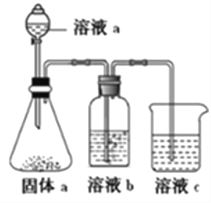
①溶液a和溶液b分别为__________,__________。
②溶液c中的离子反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2) 提取铜的操作流程如图:。
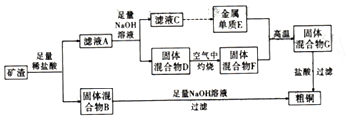
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)铁在元素周期表中的位置为___________;固体混合物B与氢氧化钠溶液反应的离子方程式为___________________。
(2)滤液A中铁元素的存在的离子形式为_______,.理由是_____________(用离子方程式表达,不必书写Cu2O 与盐酸的反应)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用多种试剂,请写出用最佳方案反应的离子方程式:_______________。
(4)工业上利用电解法进行粗铜精炼时,下列叙述正确的是______ (填序号)。
a.电解过程中,阳极质量的减轻量一定等于阴极质量的增加量
b.粗铜接电源正极,发生氧化反应
c.电解过程中,粗铜中所有杂质均被氧化
d.电解精炼过程中可以用硝酸银溶液作电解质溶液
(5)取320g固体混合物F 于硬质玻璃管中,通入足量氢气充分加热还原,固体质量减轻80g,若将所得的还原产物与足量稀盐酸反应,产生的H2在标准状况的体积为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。试回答:
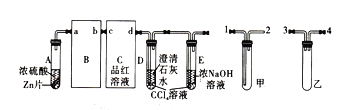
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接_____、______接b,c接_____、______接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为__________________;D、E试管中CCl4溶液的作用是__________。
(3)D中浑浊消失的离子方程式为___________________。
(4)如果锌完全溶解,共生成气体5.6L(标准状况),将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,则反应共消耗锌____g,生成气体的成分及体积之比为_______。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的___(填“氧化性”“还原性”或“漂白性”),请写出反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,不正确的是( ) 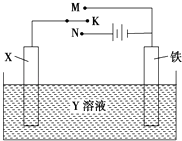
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
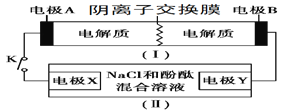
A. 闭合K时,X的电极反应式为:2H++2e-= H2↑
B. 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C. 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D. 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2=N2+6HCl,同时生成白烟并发红光。回答下列问题。
(1)实验室制氨气的化学反应方程式是:____________________________。
(2)在2NH3+3Cl2=N2+6HCl反应中,氨气表现了___________的化学性质, 请列举出NH3的另一个化学性质:__________________________。
(3)实验中生成的白烟是_____________________。
(4)反应完成后,将导管插入烧杯的水面下,并打开止水夹,观察到有水吸入烧瓶中形成喷泉,当喷泉停止后,烧瓶___________(填“能”或“不能”)被水充满。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com