
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£� �ٸ������ù�����̼��ԭ���������Ƶôֹ裬ͬʱ�õ�һ�ֿ�ȼ�����壻
�ڴֹ�������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2����
SiHCl3+H2����
��SiHCl3�������H2��1 100��1 200����¶��·�Ӧ�Ƶô��裬��֪SiHCl3����ˮ���ҷ�Ӧ���ڿ���������ȼ��
��ش�
��1����һ����ȡ�ֹ�Ļ�ѧ��Ӧ����ʽΪ ��
��2���ֹ���HCl���巴Ӧ��ȫ�������õ���SiHCl3���е�33.0�棩�к�������SiCl4���е�57.6�棩��HCl���е㩁84.7�棩���ᴿSiHCl3���õķ���Ϊ ��
��3��ʵ������SiHCl3�������H2��Ӧ��ȡ����װ����ͼ��ʾ�����Ⱥͼг�װ����ȥ���� 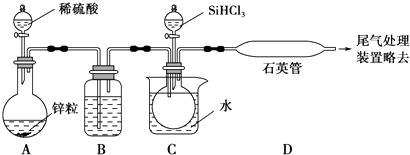
��װ��B�е��Լ��� �� װ��C�е��ձ���Ҫ���ȣ�Ŀ���� ��
�ڷ�Ӧһ��ʱ���װ��D�й۲쵽�������� �� װ��D���ܲ�����ͨ�����ܵ�ԭ���� �� װ��D�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ� ��
���𰸡�
��1��2C+SiO2 ![]() Si+2CO��
Si+2CO��
��2���������
��3��Ũ���ʹSiHCl3��������������Ӧ���й����������ɣ��¶�̫�ߣ���ͨ���������ۻ���SiHCl3+H2 ![]() Si+3HCl���ž�װ���еĿ���
Si+3HCl���ž�װ���еĿ���
���������⣺��1�������£�̼����ԭ��ʱ������CO����2C+SiO2 ![]() Si+2CO�������Դ��ǣ�2C+SiO2
Si+2CO�������Դ��ǣ�2C+SiO2 ![]() Si+2CO����2�����÷е�IJ�ͬ�ᴿSiHCl3�����������Դ��ǣ��������3�������ɵ���������ˮ��������ŨH2SO4������ȴ�ʹSiHCl3���������Դ��ǣ�Ũ���ʹSiHCl3��������������Ӧ����SiHCl3��������Ӧ�й赥�����ɣ����ݹ����ɫ�ж�Dװ���е���ɫ�仯����Ӧ�¶Ƚϸߣ���ͨ������������SiHCl3��H2��Ӧ���ɹ���Ȼ��⣬���Դ��ǣ��й����������ɣ��¶�̫�ߣ���ͨ���������ۻ���SiHCl3+H2
Si+2CO����2�����÷е�IJ�ͬ�ᴿSiHCl3�����������Դ��ǣ��������3�������ɵ���������ˮ��������ŨH2SO4������ȴ�ʹSiHCl3���������Դ��ǣ�Ũ���ʹSiHCl3��������������Ӧ����SiHCl3��������Ӧ�й赥�����ɣ����ݹ����ɫ�ж�Dװ���е���ɫ�仯����Ӧ�¶Ƚϸߣ���ͨ������������SiHCl3��H2��Ӧ���ɹ���Ȼ��⣬���Դ��ǣ��й����������ɣ��¶�̫�ߣ���ͨ���������ۻ���SiHCl3+H2 ![]() Si+3HCl�� �������ǿ�ȼ�����壬�ײ�����ը��Ϊ��ֹ��ȫ�¹ʵķ�����������ͨһ��ʱ��H2 �� ��װ���еĿ����ž������Դ��ǣ��ž�װ���еĿ�����
Si+3HCl�� �������ǿ�ȼ�����壬�ײ�����ը��Ϊ��ֹ��ȫ�¹ʵķ�����������ͨһ��ʱ��H2 �� ��װ���еĿ����ž������Դ��ǣ��ž�װ���еĿ�����


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е�һ�����ڷ������Ͱ�����Ӱ��һ���˵���������Ҫ������Եĸо������˷ܼ����ĵ���Ϣ���ݣ�ʹ�˸е����úͿ��֡��������������������������ϣ��پ�п��ԭˮ����ã��ϳɹ������£�
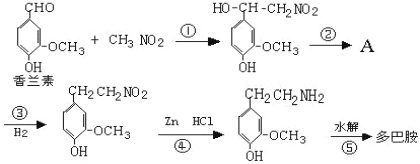
��֪��Ͱ��Ľṹ��ʽΪ��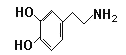 ��
��
��ش��������⣺
��1�������س���ȩ��֮�⣬�����й����������� ������������������
��2����Ͱ��ķ���ʽ�� ��
��3�������ϳɹ��������ڼӳɷ�Ӧ���͵��ǣ����������������Ӧ��ţ�����Ӧ���ķ�Ӧ������ ������ ��
��4��д���������������Ķ�Ͱ�������һ��ͬ���칹��Ľṹ��ʽ�� ��
������1��3��5-��ȡ������ ��������ֱ������һ���ǻ���һ��������
���ֱ������ƺ��������Ʒ�Ӧ�����������������Ƶ����ʵ���֮��Ϊ2��1��
��5����д���л���A������Ũ��ˮ��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��S2Cl2��һ���ӷ���Һ�壨�۵㣺��76�棬�е㣺138�棩��������ˮ����ˮ�ⷴӦ����������H2S��SO2��H2SO3��H2SO4�����ʣ����������������ڵ�����ͨ��������������S2Cl2 �� ��ͼ��ʵ������S��Cl2�Ʊ�S2Cl2��װ�ã��г�װ�á�����װ�þ�����ȥ���� 
��1����֪S2Cl2���ӽṹ��H2O2���ƣ���S2Cl2�ķ����й����������ۼ���
��2��װ��a��Ӧ���Լ�Ϊ��װ��d�������� �� ���������� ��
��3����ʵ��IJ���˳��ӦΪ������ű�ʾ���� �ټ���װ��c ��ͨ��Cl2��ͨ����ˮ ��ֹͣͨCl2��ֹͣ����װ��c
��4��ͼ��fװ����Ӧ���õ��Լ�Ϊ �� ������Ϊ ��
��5����S2Cl2��ˮ���������ͨ����ˮ�У����۲쵽���������֤��ˮ����������������ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������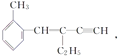 �����н�����ȷ����( )
�����н�����ȷ����( )
A. ���л������ʽΪC13H16 B. ���л������ڱ���ͬϵ��
C. ���л������������4��̼ԭ�ӹ�ֱ�� D. ���л�����������13��̼ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪ���ֵ��ʣ�����ʱ��A��B�����壬C��D�ǹ��壮E��F��G��H��IΪ���ֻ����F����ˮ��EΪ�����Ҽ�����ˮ��Ϊ��ɫ��Һ��G����ˮ�û���ɫ��Һ����������ʼ䷴Ӧ��ת����ϵ��ͼ��ʾ 
��1��д�����ֵ��ʵĻ�ѧʽ ABCD
��2��д��H+B��G�����ӷ���ʽ��
��3��д��G+I��H+D+E�Ļ�ѧ����ʽ��
��4��ij������B��Ư�ۣ� ��д����Ư�۵Ļ�ѧ����ʽ ��
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ij��С�����������ʵ�飺��ȡƯ��3.0g����ĥ���ܽ⣬���ó�250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ���������ᣨ��ʱ���������ӷ���ʽΪ���������ã�����ȫ��Ӧ����0.2molL��1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷֵ���������Ϊ������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶���,������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ,���б�����ȷ���� ( )
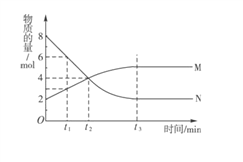
A. ��ѧ����ʽΪ2MN B. t2ʱ,���淴Ӧ�������,�ﵽƽ��
C. t2ʱ,����Ӧ���ʴ����淴Ӧ���� D. t1ʱ,M��Ũ����NŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪: 2SO2(g)+O2(g)![]() 2SO3(g) ��H=-XkJ/mol��
2SO3(g) ��H=-XkJ/mol��
2NO(g)+O2(g)![]() 2NO2(g) ��H=-YkJ/mol��
2NO2(g) ��H=-YkJ/mol��
��ӦNO(g)+SO2(g)![]() SO3(g)+NO(g) ����H=______ kJ/mol��
SO3(g)+NO(g) ����H=______ kJ/mol��
��2��������һ�ָ�Ч��������Դ��0.25mol������ȫȼ������Һ̬ˮʱ�ų�����222.5kJ�������ȼ�յ��Ȼ�ѧ����ʽΪ____________��
��3����KOH��ҺΪ�������Һ������(2)�з�Ӧ���һ��ԭ��أ��为����ӦʽΪ_______����H2SO4��ҺΪ�������Һ��������ȼ�ϵ���еļ����ΪC2H5OH���为����ӦʽΪ_________��
��4������������ȼ�ϵ��Ϊ��Դ���ò��缫���1LCu(NO3)2��KNO3�����Һ��ͨ��һ��ʱ��������������11.2L(��״��)���塣�������Һ��pHΪ______(����������Һ�������)��ԭ�����Һ��Cu2+�����ʵ���Ũ��Ϊ___________�����������������������Ϊ80%���ڼ���ȼ�ϵ�������ĵļ����ڱ�״���µ����Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й�������ȷ����

A. ͭ�缫�Ϸ���������Ӧ
B. ��ع���һ��ʱ��׳ص�c(SO42��)����
C. ��ع���һ��ʱ����ҳ���Һ����������С
D. �������ӷֱ�ͨ������Ĥ���������ƶ���������Һ�е��ƽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com