
【题目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________,其中未成对电子数为____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________。ZnGeAs2中Zn、Ge、As的电负性从大到小的顺序为________________。
(3)聚吡咯的单体为吡咯(![]() ),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
立方碳化硅 | 晶体硅 | 金刚石 | |
熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:__________________________________________________。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
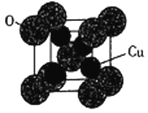
①氧化亚铜属于__________晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3(列出计算式即可)。
【答案】 [Ar]3d54s1 6 As>Ge>Ga As>Ge>Zn sp3 5∶1 它们都是具有正四面休形空间网状结构的原子晶体,结合力为共价键,由于键长C-C<c-si<si-si,键能c-c>C-Si>Si-Si,故熔点:金刚石>立方碳化硅>晶体硅</c-si<si-si,键能c-c> 离子 ![]() ×107
×107
【解析】试题分析:(1)基态铬原子的核外有24个电子,根据能量最低等原则排布核外电子; 3d54s1都是未成对电子;(2)同周期元素从左到右第一电离能逐渐增大;非金属性越强电负性越大;(3) 氮原子的价电子对数![]() ;单键为σ键、双键中一个是σ键一个是π键;(4) 熔点:金刚石>立方碳化硅>晶体硅;它们都是原子晶体,结合力为共价键,键长C-C<C-Si<Si-Si;(5)根据氧化亚铜的熔点为1235℃分析其晶体类型;②根据均摊原则计算晶胞中亚铜离子、氧离子数,根据a=425.8pm计算1mol晶胞的体积,根据
;单键为σ键、双键中一个是σ键一个是π键;(4) 熔点:金刚石>立方碳化硅>晶体硅;它们都是原子晶体,结合力为共价键,键长C-C<C-Si<Si-Si;(5)根据氧化亚铜的熔点为1235℃分析其晶体类型;②根据均摊原则计算晶胞中亚铜离子、氧离子数,根据a=425.8pm计算1mol晶胞的体积,根据![]() 计算密度。
计算密度。
解析:(1)基态铬原子的核外有24个电子,核外电子排布式为[Ar]3d54s1;3d54s1都是未成对电子,所以未成对电子数是6;(2) 同周期元素从左到右第一电离能逐渐增大,所以Ge、Ga、As的第一电离能从大到小的顺序为As>Ge>Ga;非金属性越强电负性越大,所以Zn、Ge、As 电负性从大到小的顺序为As>Ge>Zn;(3) 氮原子的价电子对数![]() ,所以氮原子的杂化轨道类型为sp3;单键为σ键、双键中一个是σ键一个是π键,所以吡咯分子中σ键与π键的数目之比为10:2=5:1;(4)它们都是具有正四面休形空间网状结构的原子晶体,结合力为共价键,由于键长C-C<C-Si<Si-Si,键能C-C>C-Si>Si-Si,所以熔点:金刚石>立方碳化硅>晶体硅;(5) ①根据氧化亚铜的熔点为1235℃,比原子晶体低,比分子晶体高,氧化亚铜属于离子晶体;②根据均摊原则,晶胞中亚铜离子数是4、氧离子数是
,所以氮原子的杂化轨道类型为sp3;单键为σ键、双键中一个是σ键一个是π键,所以吡咯分子中σ键与π键的数目之比为10:2=5:1;(4)它们都是具有正四面休形空间网状结构的原子晶体,结合力为共价键,由于键长C-C<C-Si<Si-Si,键能C-C>C-Si>Si-Si,所以熔点:金刚石>立方碳化硅>晶体硅;(5) ①根据氧化亚铜的熔点为1235℃,比原子晶体低,比分子晶体高,氧化亚铜属于离子晶体;②根据均摊原则,晶胞中亚铜离子数是4、氧离子数是![]() ,所以晶胞的摩尔质量是288g/mol, a=425.8pm,晶胞的体积为
,所以晶胞的摩尔质量是288g/mol, a=425.8pm,晶胞的体积为![]() ,
, ![]() =
=![]()
![]() ×107 g·cm-3。
×107 g·cm-3。


科目:高中化学 来源: 题型:
【题目】碳酸锶主要用于彩电显像管的荧屏玻璃和特种玻璃等的制造,通常由天青石矿(主要成分为SrSO4,还含有钡等杂质)制备,制备流程如图所示:
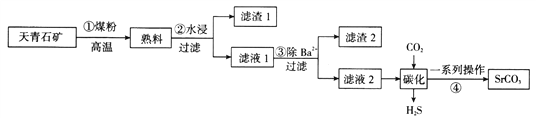
已知:i.锶在“滤液1”“滤液2”中均主要以Sr(HS)2、Sr(OH)2形式存在
ii.SrSO4、BaSO4的KSP分别是3.2×10-7、1.0×10-10
回答下列问题:
(1)步骤①反应:SrSO4+2C![]() SrS+2CO2↑,若在标准状况下产生3.36 LCO2,则转移电子数为__________________。
SrS+2CO2↑,若在标准状况下产生3.36 LCO2,则转移电子数为__________________。
(2)写出步骤②中“水浸”主要反应的化学方程式:________________________。步骤②“过滤”操作需要的主要玻璃仪器为________________________。
(3)上述生产工艺的优点是质量好、成本低,但从环保角度考虑该工艺生产存在明显的缺点是______________________________________________________。
(4)若向含有Sr2+、Ba2+的“滤液1”中滴加稀硫酸,当两种沉淀共存时,c(Sr2+):c(Ba2+)=________________。
(5)写出“碳化”过程中发生反应的化学方程式:_______________________________。
(6)某生产企业用a kg的天青石矿(含SrSO4:40%)制备,最终得到b kg碳酸锶产品,产率为______________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH容液,其工作原理如图所示。
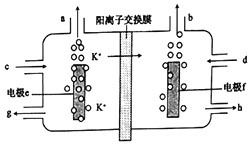
下列说法正确的是( )
A. 电极f为阳极,电极e上H+发生还原反应
B. 电极e的电极反应式为4OH--4e-=2H2O+O2↑
C. d处流进粗KOH溶液,g处流出纯KOH溶液
D. b处每产生11.2L气体,必有1molK+穿过阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中所列出的物质 , 属于 贴错了标签的是( )
选项 | A | B | C | D |
物质的化学式 | HNO3(浓) | 乙醇 | P4 | CCl4 |
危险警告标签 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某 KCl 样品中含有少量 K2CO3、K2SO4 和不溶于水的杂质。为了提纯 KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是

A. 步骤④的操作是过滤
B. 试剂Ⅰ为 BaCl2 溶液
C. 上图过程须经 2 次过滤
D. 步骤③目的是除去 Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉和纤维素不属于同分异构体的原因是 ( )
A. 组成的元素不同 B. 物理性质、化学性质不同
C. 组成的单糖单元数不相同 D. 分子结构不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
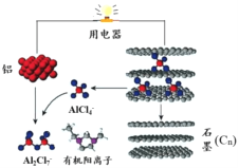
A. 放电时,铝为负极,石墨为正极
B. 放电时的负极反应为:Al-3e-+7AlCl4-===4Al2Cl7-
C. 充电时的阳极反应为:Cx+ AlCl4--e-===CxAlCl4
D. 放电时,有机阳离子向铝电极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com