
【题目】25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
【答案】B
【解析】A.醋酸根离子水解,浓度越大,水解程度越小,0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液相比,前者水解程度小,二者的c(CH3COO-)之比>2:1,故A错误;B.根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+2c(SO42- ),溶液呈中性,则c(H+)=c(OH-),则c(NH4+)=2c(SO42- ),故B正确;C.等质量的Na2CO3和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比=![]() ×2:
×2: ![]() ×1<2:1,故C错误;D.pH=2的H2SO4溶液与pH=2的盐酸溶液中,溶液中氢离子浓度都是0.01mol/L,故D错误;故选B。
×1<2:1,故C错误;D.pH=2的H2SO4溶液与pH=2的盐酸溶液中,溶液中氢离子浓度都是0.01mol/L,故D错误;故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________,其中未成对电子数为____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________。ZnGeAs2中Zn、Ge、As的电负性从大到小的顺序为________________。
(3)聚吡咯的单体为吡咯(![]() ),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
立方碳化硅 | 晶体硅 | 金刚石 | |
熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:__________________________________________________。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
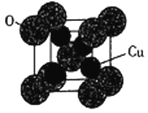
①氧化亚铜属于__________晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的电化学装置以甲醇(CH3OH)为主要原料合成碳酸二甲酯[(CH3O)2CO],相关说法错误的是
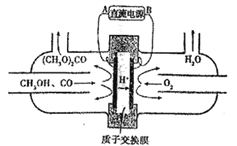
A. B是直流电源的负极
B. 碳酸二甲酯中碳均为+4价
C. 阳极附近溶液pH降低
D. 每当有2molH+通过离子交换膜,消耗氧气的体积在标准状况下为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氯化磷(PCl5)常温下是一种淡黄色固体,在潮湿空气中水解产生两种酸。PCl5在有机合成中被广泛用作氯化剂、催化剂、脱水剂等,高纯度PCl5主要用于医药中间体及锂电池原材料的合成。工业生产PCl5的传统方法是在搅拌式反应釜中注入液体三氯化磷(PCl3),再通入氯气在合适的温度下发生反应:PCl3+Cl2![]() PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
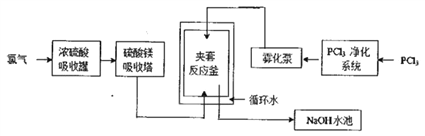
请回答下列相关问题。
(1)工业生产氯气的主要方法的离子方程式是___________,利用该反应所得产品可继续生产_________(任写一种)等化工产品。
(2)浓硫酸吸收罐和硫酸镁吸收塔的作用是______________________,若去掉这两个设备夹套反应釜中发生的主要副反应是______________________________。
(3)夹套反应釜中的原料混合方式与搅拌式反应釜相比主要优点是____________________________。 (4)NaOH水池的作用是_______________________,从降低生产成本的角度考虑NaOH溶液可更换为______。
(5)生产过程中PCl3的加料速率会对生产造成明显的影响,具体情况如下表。根据表中数据判断最佳的加料速率范围是_________________kg·h-1。
PCl3加料速率/kg·h-1 | PCl5状态 | 热交换情况 | 生产500kg产品的周期/h |
40 | 致密、坚硬、造粒困难 | 快、温度可控 | 11.5 |
50 | 致密、坚硬、造粒困难 | 快、温度可控 | 9.2 |
60 | 较松散、造粒容易 | 较快、温度可控 | 7.2 |
70 | 松散、造粒容易 | 较快、温度可控 | 6.5 |
80 | 松散、造粒容易 | 慢、温度升高难以控制 | 5.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是:
A. 将铜丝插入稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+H2O
===Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe===2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1894年,Fenton发现采用Fe2+和H2O2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(-OH),从而氧化降解有机污染物,称为Fenton反应。电Fenton法采用惰性电极电解法,右图为其中一个电极的反应机理,其中含有Fenton反应。下列说法不正确的是( )
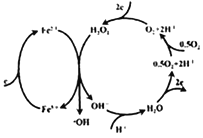
A. 羟基自由基(-OH)的电子式为:![]()
B. 右图所在的惰性电极应与外接电源的负极相连
C. Fenton反应:Fe2++H2O2==Fe3++OH-+-OH
D. 右图所在的惰性电极每消耗22.4LO2(标准状况),理论上在外电电路中转移4mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2﹣与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是( )
A.原子序数X>Y
B.离子半径X>Y
C.X和Y一定在同一周期
D.X是第IIA族元素,Y是第VIIA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q、r,t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:W>Z>Y>X
B. Z分别与Y、W组成的化合物中化学键类型可能相同
C. v能抑制水的电离而u能促进水的电离
D. 粘有q的试管可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为__________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1。
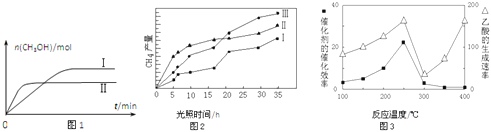
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ__________KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为__________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为__________(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com