
【题目】五氯化磷(PCl5)常温下是一种淡黄色固体,在潮湿空气中水解产生两种酸。PCl5在有机合成中被广泛用作氯化剂、催化剂、脱水剂等,高纯度PCl5主要用于医药中间体及锂电池原材料的合成。工业生产PCl5的传统方法是在搅拌式反应釜中注入液体三氯化磷(PCl3),再通入氯气在合适的温度下发生反应:PCl3+Cl2![]() PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
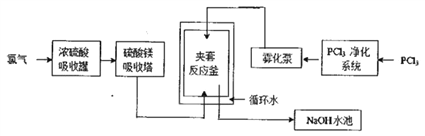
请回答下列相关问题。
(1)工业生产氯气的主要方法的离子方程式是___________,利用该反应所得产品可继续生产_________(任写一种)等化工产品。
(2)浓硫酸吸收罐和硫酸镁吸收塔的作用是______________________,若去掉这两个设备夹套反应釜中发生的主要副反应是______________________________。
(3)夹套反应釜中的原料混合方式与搅拌式反应釜相比主要优点是____________________________。 (4)NaOH水池的作用是_______________________,从降低生产成本的角度考虑NaOH溶液可更换为______。
(5)生产过程中PCl3的加料速率会对生产造成明显的影响,具体情况如下表。根据表中数据判断最佳的加料速率范围是_________________kg·h-1。
PCl3加料速率/kg·h-1 | PCl5状态 | 热交换情况 | 生产500kg产品的周期/h |
40 | 致密、坚硬、造粒困难 | 快、温度可控 | 11.5 |
50 | 致密、坚硬、造粒困难 | 快、温度可控 | 9.2 |
60 | 较松散、造粒容易 | 较快、温度可控 | 7.2 |
70 | 松散、造粒容易 | 较快、温度可控 | 6.5 |
80 | 松散、造粒容易 | 慢、温度升高难以控制 | 5.3 |
【答案】 )2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 盐酸或漂白液或NaClO溶液 干燥氯气 PCl5+4H2O=H3PO4+5HCl 或 PCl5+3H2O=HPO3+5HCl 反应物接触更充分,反应速率更快(合理即可) 吸收剩余的氯气,防止污染空气 石灰乳 60~70
2OH-+H2↑+Cl2↑ 盐酸或漂白液或NaClO溶液 干燥氯气 PCl5+4H2O=H3PO4+5HCl 或 PCl5+3H2O=HPO3+5HCl 反应物接触更充分,反应速率更快(合理即可) 吸收剩余的氯气,防止污染空气 石灰乳 60~70
【解析】 (1)工业生产氯气的主要方法是电解饱和食盐水,其离子方程式是2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,利用该反应所得氯气、氢气和氢氧化钠,可继续生产盐酸、漂白液或NaClO溶液等化工产品。
2OH-+H2↑+Cl2↑,利用该反应所得氯气、氢气和氢氧化钠,可继续生产盐酸、漂白液或NaClO溶液等化工产品。
(2)浓硫酸吸收罐和硫酸镁吸收塔的作用是干燥氯气,若去掉这两个设备,由题中信息可知,五氯化磷(PCl5)在潮湿空气中水解产生两种酸,所以夹套反应釜中发生的主要副反应是PCl5+4H2O=H3PO4+5HCl 或 PCl5+3H2O=HPO3+5HCl。
(3)夹套反应釜中的原料通过雾化泵把三氧化磷雾化与氯气混合,与搅拌式反应釜相比,这种混合方式的主要优点是反应物接触更充分,反应速率更快。
(4)NaOH水池的作用是吸收剩余的氯气,防止污染空气,从降低生产成本的角度考虑NaOH溶液可更换为石灰乳。
(5)由表中数据可知,加料速率范围在60~70kg·h-1时,五氯化磷较松散、造粒容易,热交接较快且温度可控,生产效率较高,所以最佳的加料速率范围是60~70kg·h-1。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH容液,其工作原理如图所示。
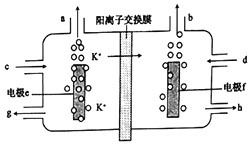
下列说法正确的是( )
A. 电极f为阳极,电极e上H+发生还原反应
B. 电极e的电极反应式为4OH--4e-=2H2O+O2↑
C. d处流进粗KOH溶液,g处流出纯KOH溶液
D. b处每产生11.2L气体,必有1molK+穿过阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
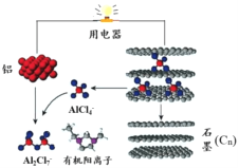
A. 放电时,铝为负极,石墨为正极
B. 放电时的负极反应为:Al-3e-+7AlCl4-===4Al2Cl7-
C. 充电时的阳极反应为:Cx+ AlCl4--e-===CxAlCl4
D. 放电时,有机阳离子向铝电极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护加酶洗衣粉洗涤效果,应注意
A. 使用沸水先冲泡洗衣粉 B. 用含氯较高的自来水作水源
C. 和其他洗涤剂混合使用 D. 室温时用饮用水先溶解洗衣粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com