
【题目】下列指定反应的离子方程式正确的是:
A. 将铜丝插入稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+H2O
===Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe===2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表中所列出的物质 , 属于 贴错了标签的是( )
选项 | A | B | C | D |
物质的化学式 | HNO3(浓) | 乙醇 | P4 | CCl4 |
危险警告标签 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,合成路线如下。
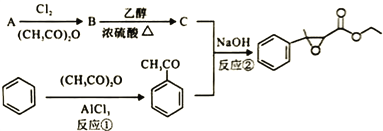
(1)杨梅醛的分子式为______________。
(2)与![]() 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
(3)反应①的反应类型为___________,该反应的另一产物在合成中可循环利用,其结构简式为___________。
(4)已知反应②的另一产物不含碳原子,B中含有的官能团为__________ (填名称),C的结构简式为___________。
(5)写出反应②的化学方程式___________。
(6)写出两种符合以下条件的杨梅醛的同分异构体的结构简式___________。
i.与FeCl3发生显色反应且能发生银镜反应
ⅱ.有三个互为间位的取代基且每个取代基含一个官能团
ⅲ含有-CH3和-CHO基团各两个
(7)根据上述合成路线写出乙酐和A为原料制备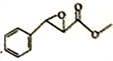 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏伽德罗常数,下列说法正确的是
A.2.3g金属钠变成钠离子时,失去的电子数为0.2NA
B.常温常压下,11.2L氯气中所含的原子数目为NA
C.通常状况下,32g氧气所含有的原子数目为2NA
D.100ml 2mol·L-1的氯化钠溶液中含各离子数目之和为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中,配制溶液需要的是_________________(填字母),配制上述溶液还需用到的玻璃仪器是__________________________(填仪器名称)。

(2)根据计算用托盘天平称取NaOH的质量为_______________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_____________(填“大于”“等于”或“小于”)0.1 mol/L。 若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作:_______。
(3)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为________mL。如果实验室有10 mL,15 mL,20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________。
(4)下列操作会使配制的NaOH溶液浓度偏低的是___________。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的操作、现象和解释或结论都正确的是
操作 | 现象 | 解释或结论 | |
A | 将饱和Na2SO4溶液加入到饱和石灰中 | 有白色沉淀 | 说明Ksp[Ca(OH)2]大于Ksp[CaSO4] |
B |
| 试剂瓶中有一段稳定水柱 | 装置气密性良好 |
C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | A13+水解生成Al(OH)3 |
D |
| 锥形瓶溶液产生淡黄色沉淀 | 苯与溴发生取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4 的质量为98 g·mol-1 B. 常温常压下11.2LCO2所含分子数为0.5NA
C. H2SO4 的摩尔质量为98 g D. 6.02×1022个H2SO4分子的质量为9.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com