
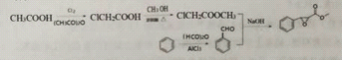
【题目】杨梅醛是常用的水果型食用香精,合成路线如下。
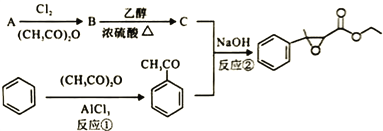
(1)杨梅醛的分子式为______________。
(2)与![]() 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
(3)反应①的反应类型为___________,该反应的另一产物在合成中可循环利用,其结构简式为___________。
(4)已知反应②的另一产物不含碳原子,B中含有的官能团为__________ (填名称),C的结构简式为___________。
(5)写出反应②的化学方程式___________。
(6)写出两种符合以下条件的杨梅醛的同分异构体的结构简式___________。
i.与FeCl3发生显色反应且能发生银镜反应
ⅱ.有三个互为间位的取代基且每个取代基含一个官能团
ⅲ含有-CH3和-CHO基团各两个
(7)根据上述合成路线写出乙酐和A为原料制备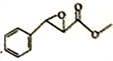 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。
【答案】 C12H14O3 4 核磁共振氢谱 取代反应 CH3COOH 羧基、氯原子 ClCH2COOCH2CH3 ![]()
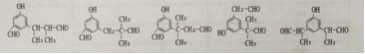
【解析】A为乙酸,B为氯乙酸,C为ClCH2COOCH2CH3 ,(1)杨梅醛的分子式为 C12H14O3;(2)与![]() 互为同分异构体的芳香醛有苯乙醛、邻、间、对甲基苯甲醛,共4种,用于鉴别这些同分异构体的方法为核磁共振氢谱,测定处于不同环境的氢原子的种类。
互为同分异构体的芳香醛有苯乙醛、邻、间、对甲基苯甲醛,共4种,用于鉴别这些同分异构体的方法为核磁共振氢谱,测定处于不同环境的氢原子的种类。
(3)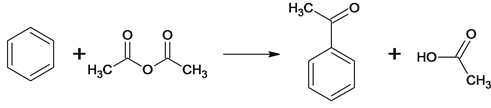 反应①的反应类型为取代反应,该反应的另一产物在合成中可循环利用,其结构简式为CH3COOH。(4)已知反应②的另一产物不含碳原子,B中含有的官能团为羧基、氯原子 ,C的结构简式为 ClCH2COOCH2CH3 。(5)反应②的化学方程式
反应①的反应类型为取代反应,该反应的另一产物在合成中可循环利用,其结构简式为CH3COOH。(4)已知反应②的另一产物不含碳原子,B中含有的官能团为羧基、氯原子 ,C的结构简式为 ClCH2COOCH2CH3 。(5)反应②的化学方程式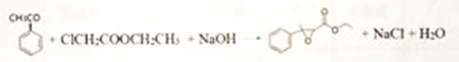 。
。
(6)i.与FeCl3发生显色反应且能发生银镜反应,有酚羟基,有醛基;ⅱ.有三个互为间位的取代基且每个取代基含一个官能团;ⅲ含有-CH3和-CHO基团各两个,符合以上条件的杨梅醛的同分异构体的结构简式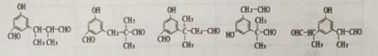 。(7)根据上述合成路线写出乙酐和A为原料制备
。(7)根据上述合成路线写出乙酐和A为原料制备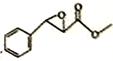 的合成路线:
的合成路线: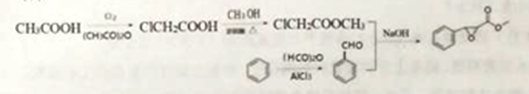


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A. 甲苯与氢气完全加成后产物的一氯代物的种类数是5种
B. 苯与液溴混合后加入铁粉可发生加成反应
C. 1 mol 苹果酸(HOOCCHOHCH2COOH)可与3 mol NaHCO3发生反应
D. 氟利昂-12的结构式为![]() ,该分子是平面型分子
,该分子是平面型分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和SO2。
(1)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________a(填“大于”“小于”或“等于”)。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应的离子方程式为______________________
(2)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,实验测定其与16.00mL 0.1000 mol/L KMnO4溶液恰好完全反应。已知(NH4)2Fe(SO4)2·6H2O的摩尔质量是392g/mol,则产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+ 2H2(g)![]() CH3OH(g),在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。则下列理解不符合题意的是
CH3OH(g),在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。则下列理解不符合题意的是
A. B点的速率比C点的大
B. A、B、C三点的平衡常数KA、KB、KC的大小关系为:KA=KB>KC
C. 若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为2L
D. 合成甲醇的反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的电化学装置以甲醇(CH3OH)为主要原料合成碳酸二甲酯[(CH3O)2CO],相关说法错误的是
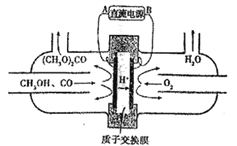
A. B是直流电源的负极
B. 碳酸二甲酯中碳均为+4价
C. 阳极附近溶液pH降低
D. 每当有2molH+通过离子交换膜,消耗氧气的体积在标准状况下为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化氢(HCN)是形成生物重要化合物的重要源或中间体,其水溶液称氢氰酸,是一种非常弱的酸。工业上以甲烷和氨气为原料在高温和催化剂的作用下按下列反应制备HCN:
2CH4(g)+3O2(g)+2NH3(g)![]() 2HCN(g)+6H2O(g) △H1=-475kJ/mol①
2HCN(g)+6H2O(g) △H1=-475kJ/mol①
CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H2=+240kJ/mol②
HCN(g)+3H2(g) △H2=+240kJ/mol②
(1)该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为________________________(数值保留三位有效数字)。根据题中信息_______________(填“能”或“不能”)计算出氢气的燃烧热。
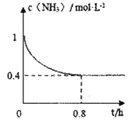
(2)在恒温恒容的密闭容器中按照体积比6:5的比例充入甲烷和氨气发生反应②,氨气的物质的量浓度与时间关系如图所示,从开始到0.8h达平衡状态的过程中v(H2)=____________________;甲烷的平衡转化率为____________;该温度下反应②的平衡常数K=________________________。
(3)工业生产中反应②常用铂作催化剂,甲、乙两名同学在讨论催化剂的选择,甲同学认为用铂作催化剂会提高生产成本,应研究出更廉价的催化剂;乙同学认为使用铂不会明显提高生产成本。你认为观点更合理的是___________(填“甲”或“乙”),原因是______________________________。
(4)HCN及其盐均有剧毒,因此含CN-的工业废水必须经过处理才能排放,处理方法之一是电解氧化法;以石墨为阳极、铁板为阴极电解含CN-的碱性废水,将CN-转化为N2和CO2。该方法的阳极反应式为___________________________。为确保CN-被完全处理掉,电解一段时间后通常会加入适量氯化钠固体,其作用可能是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是:
A. 将铜丝插入稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+H2O
===Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe===2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com