
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
【答案】 提高溶液pH,去除Fe3+(使之转化为Fe(OH)3)(只答出了调节pH不得 CuS “除Cu”时溶液pH会降低,可能会溶解部分Fe(OH)3沉淀 Ca2++2F-=CaF2↓ 3Ni+3H2SO4+2HNO3=3NiSO4+2NO↑+4H2O 过滤 洗涤 CO、CO2 2Ni(OH)2+ClO-=Ni2O3+Cl-+2H2O 10-52
【解析】(1)铁能够和盐酸反应生成亚铁离子,被双氧水氧化为铁离子,然加入碳酸钙调pH,使铁离子变为沉淀而除去;铜和混合酸反应生成铜离子,加入硫化氢后产生硫化铜沉淀,得到“沉渣2”; 必须先过滤“沉渣1”后再进行“除Cu”的原因是“除Cu”时溶液pH会降低,可能会溶解部分Fe(OH)3沉淀;正确答案:提高溶液pH,去除Fe3+(使之转化为Fe(OH)3) ;CuS; “除Cu”时溶液pH会降低,可能会溶解部分Fe(OH)3沉淀。
(2)溶液中的氟离子与钙离子反应生成氟化钙沉淀,达到除钙的目的;离子方程式为Ca2++2F-=CaF2↓;正确答案:Ca2++2F-=CaF2↓。
(3)假设H2SO4与HNO3物质的量分别为3mol,2mol;两种混合酸提供氢离子8mol,,2mol硝酸根离子全部被还原为2mol一氧化氮,转移电子总数为6mol;镍在反应中被氧化为硫酸镍,根据电子守恒可知,消耗金属镍3mol;根据上述反应关系,该反应化学方程式为:3Ni+3H2SO4+2HNO3=3NiSO4+2NO↑+4H2O;正确选项:3Ni+3H2SO4+2HNO3=3NiSO4+2NO↑+4H2O。
(4)滤液中加入草酸形成草酸镍固体,然后进行过滤、洗涤操作;草酸镍煅烧后变为三氧化二镍、一氧化碳和二氧化碳气体;正确答案:过滤;洗涤;CO、CO2。
(5)向NiO中加入盐酸溶解,待完全溶解后生成氯化镍,氯化镍在碱性环境下被次氯酸钠氧化为三氧化二镍、次氯酸钠被还原为氯化钠,离子方程式为:2Ni(OH)2+ClO-=Ni2O3+Cl-+2H2O ;正确答案:2Ni(OH)2+ClO-=Ni2O3+Cl-+2H2O。


科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,合成路线如下。
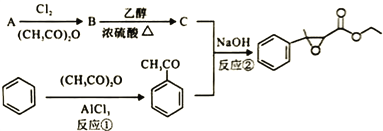
(1)杨梅醛的分子式为______________。
(2)与![]() 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
(3)反应①的反应类型为___________,该反应的另一产物在合成中可循环利用,其结构简式为___________。
(4)已知反应②的另一产物不含碳原子,B中含有的官能团为__________ (填名称),C的结构简式为___________。
(5)写出反应②的化学方程式___________。
(6)写出两种符合以下条件的杨梅醛的同分异构体的结构简式___________。
i.与FeCl3发生显色反应且能发生银镜反应
ⅱ.有三个互为间位的取代基且每个取代基含一个官能团
ⅲ含有-CH3和-CHO基团各两个
(7)根据上述合成路线写出乙酐和A为原料制备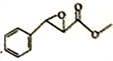 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中,配制溶液需要的是_________________(填字母),配制上述溶液还需用到的玻璃仪器是__________________________(填仪器名称)。

(2)根据计算用托盘天平称取NaOH的质量为_______________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_____________(填“大于”“等于”或“小于”)0.1 mol/L。 若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作:_______。
(3)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为________mL。如果实验室有10 mL,15 mL,20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________。
(4)下列操作会使配制的NaOH溶液浓度偏低的是___________。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的操作、现象和解释或结论都正确的是
操作 | 现象 | 解释或结论 | |
A | 将饱和Na2SO4溶液加入到饱和石灰中 | 有白色沉淀 | 说明Ksp[Ca(OH)2]大于Ksp[CaSO4] |
B |
| 试剂瓶中有一段稳定水柱 | 装置气密性良好 |
C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | A13+水解生成Al(OH)3 |
D |
| 锥形瓶溶液产生淡黄色沉淀 | 苯与溴发生取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VL 浓度为1mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A.通入标准状况下的HC1气体22.4VL
B.将溶液加热浓缩到0.5VL
C.加入10mol·L-1的盐酸0.2VL,再稀释至1.5VL
D.加入VL3mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分

(1)⑤⑥⑦⑨⑩的离子半径由大到小的顺序为______________________(用离子符号表示)。
(2)③与⑩形成的一种化合物每个原子最外层都满足8e-结构,写出该化合物的电子式________。
(3)①②两种元素以原子个数比为3:1形成的一种化合物,写出其二氯取代物的结构简式:_____。
(4)与③同主族的元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式__________________________________。
(5)由④⑥两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,写出该反应的离子方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol C2H2O4的质量是_______g,约含______个C2H2O4分子,含______mol氧原子。
(2)38.4g SO2在标准状况下的体积为___________L,该气体在标准状况下的密度是______________。
(3)在标准状况下,将_______L NH3溶于水得到0.5 mol·L-1的氨水250 mL;配制100 mL 0.2 mol·L-1CuSO4溶液,需要CuSO4·5H2O________g。
(4)液态化合物XY2在一定量O2中恰好完全燃烧(XY2(液)+ 3O2(气)= XO2(气)+ 2YO2(气)),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是___________mL。 ②化合物XY2的摩尔质量是___________。
③若XY2分子中X、Y两元素的质量之比为3:16,则X、Y两元素分别是_________和________。(写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4 的质量为98 g·mol-1 B. 常温常压下11.2LCO2所含分子数为0.5NA
C. H2SO4 的摩尔质量为98 g D. 6.02×1022个H2SO4分子的质量为9.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,将11.2 LHCl气体溶于水,制成250mL溶液。
(1)试求该盐酸溶液的物质的量浓度______;
(2)如果用质量分数为36.5%密度为1.2 g/cm3 的浓盐酸来配制上述溶液,则应量取该浓盐酸多少毫升进行稀释____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com