
【题目】氰化氢(HCN)是形成生物重要化合物的重要源或中间体,其水溶液称氢氰酸,是一种非常弱的酸。工业上以甲烷和氨气为原料在高温和催化剂的作用下按下列反应制备HCN:
2CH4(g)+3O2(g)+2NH3(g)![]() 2HCN(g)+6H2O(g) △H1=-475kJ/mol①
2HCN(g)+6H2O(g) △H1=-475kJ/mol①
CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H2=+240kJ/mol②
HCN(g)+3H2(g) △H2=+240kJ/mol②
(1)该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为________________________(数值保留三位有效数字)。根据题中信息_______________(填“能”或“不能”)计算出氢气的燃烧热。
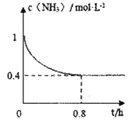
(2)在恒温恒容的密闭容器中按照体积比6:5的比例充入甲烷和氨气发生反应②,氨气的物质的量浓度与时间关系如图所示,从开始到0.8h达平衡状态的过程中v(H2)=____________________;甲烷的平衡转化率为____________;该温度下反应②的平衡常数K=________________________。
(3)工业生产中反应②常用铂作催化剂,甲、乙两名同学在讨论催化剂的选择,甲同学认为用铂作催化剂会提高生产成本,应研究出更廉价的催化剂;乙同学认为使用铂不会明显提高生产成本。你认为观点更合理的是___________(填“甲”或“乙”),原因是______________________________。
(4)HCN及其盐均有剧毒,因此含CN-的工业废水必须经过处理才能排放,处理方法之一是电解氧化法;以石墨为阳极、铁板为阴极电解含CN-的碱性废水,将CN-转化为N2和CO2。该方法的阳极反应式为___________________________。为确保CN-被完全处理掉,电解一段时间后通常会加入适量氯化钠固体,其作用可能是_____________________________。
【答案】 H2O(g)=1/2O2(g)+H2(g) △H=+159kJ/mol 不能 2.25 mol·L-1·h-1 50% 14.58 mol2·L-2 乙 生产过程中催化剂不报耗 2CN--10e-+8OH-=N2+2CO2+4H2O 增强溶液的导电能力
【解析】氰化氢(HCN)是形成生物重要化合物的重要源或中间体,其水溶液称氢氰酸,是一种非常弱的酸。工业上以甲烷和氨气为原料在高温和催化剂的作用下按下列反应制备HCN:
(1) 2CH4(g)+3O2(g)+2NH3(g)![]() 2HCN(g)+6H2O(g) △H1=-475kJ/mol①;CH4(g)+NH3(g)
2HCN(g)+6H2O(g) △H1=-475kJ/mol①;CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H2=+240kJ/mol②。由(②
HCN(g)+3H2(g) △H2=+240kJ/mol②。由(②![]() ①)
①)![]() 可得H2O(g)= H2(g)+
可得H2O(g)= H2(g)+ ![]() O2(g),△H=[+240kJ/mol
O2(g),△H=[+240kJ/mol![]() (-475kJ/mol)]
(-475kJ/mol)]![]() +159kJ/mol,所以,该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为H2O(g)= H2(g)+
+159kJ/mol,所以,该条件下1mol水蒸气分解为氢气和氧气的热化学方程式为H2O(g)= H2(g)+ ![]() O2(g) △H=+159kJ/mol。因为不知道水蒸气变成液态水的热效应,根据题中信息不能计算出氢气的燃烧热。
O2(g) △H=+159kJ/mol。因为不知道水蒸气变成液态水的热效应,根据题中信息不能计算出氢气的燃烧热。
(2)在恒温恒容的密闭容器中按照体积比6:5的比例充入甲烷和氨气发生反应②CH4(g)+NH3(g)![]() HCN(g)+3H2(g),由图可知,从开始到0.8h达平衡状态的过程中氨气的浓度从1mol/L减少到0.4mol/L,氨气的变化量为0.6mol/L,则氢气的变化量为1.8mol/L,v(H2)=
HCN(g)+3H2(g),由图可知,从开始到0.8h达平衡状态的过程中氨气的浓度从1mol/L减少到0.4mol/L,氨气的变化量为0.6mol/L,则氢气的变化量为1.8mol/L,v(H2)=![]() 2.25 mol·L-1·h-1;由氨气的起始量可以求出甲烷的起始量为1.2mol/L,变化量与氨气相同,也是0.6mol/L,所以甲烷的平衡转化率为50%;该温度下反应②的平衡常数K=
2.25 mol·L-1·h-1;由氨气的起始量可以求出甲烷的起始量为1.2mol/L,变化量与氨气相同,也是0.6mol/L,所以甲烷的平衡转化率为50%;该温度下反应②的平衡常数K=![]() 14.58 mol2·L-2。
14.58 mol2·L-2。
(3)工业生产中反应②常用铂作催化剂,甲、乙两名同学在讨论催化剂的选择,甲同学认为用铂作催化剂会提高生产成本,应研究出更廉价的催化剂;乙同学认为使用铂不会明显提高生产成本。两种观点更合理的是乙,原因是生产过程中催化剂不报耗。
(4)以石墨为阳极、铁板为阴极电解含CN-的碱性废水,由题意可知,在阳极上CN-被氧化为N2和CO2,阳极的电极反应式为2CN--10e-+8OH-=N2+2CO2+4H2O。为确保CN-被完全处理掉,电解一段时间后,溶液中的离子浓度减小,故其导电性减弱,通常会加入适量氯化钠固体,以增强溶液的导电能力,提高电解效率。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中科大发现了人工合成金刚石的新方法,化学原理为:Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
A. 该反应中,钠作还原剂,二氧化碳作氧化剂
B. 每生成1mol Na2CO3时,共转移4mol电子
C. 该反应中Na2CO3是氧化产物
D. 还原性Na大于C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业生产中用的波尔多液杀菌剂由硫酸铜和石灰乳按一定比例配制而成,它能防治植物病害的原因是( )
A.硫酸铜使菌体蛋白质盐析
B.石灰乳使菌体蛋白质水解
C.菌体蛋白质能溶解于波尔多液中
D.铜离子和石灰乳使菌体蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,合成路线如下。
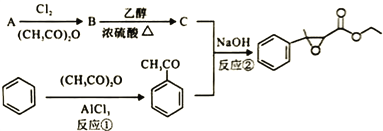
(1)杨梅醛的分子式为______________。
(2)与![]() 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
(3)反应①的反应类型为___________,该反应的另一产物在合成中可循环利用,其结构简式为___________。
(4)已知反应②的另一产物不含碳原子,B中含有的官能团为__________ (填名称),C的结构简式为___________。
(5)写出反应②的化学方程式___________。
(6)写出两种符合以下条件的杨梅醛的同分异构体的结构简式___________。
i.与FeCl3发生显色反应且能发生银镜反应
ⅱ.有三个互为间位的取代基且每个取代基含一个官能团
ⅲ含有-CH3和-CHO基团各两个
(7)根据上述合成路线写出乙酐和A为原料制备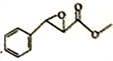 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏伽德罗常数,下列说法正确的是
A.2.3g金属钠变成钠离子时,失去的电子数为0.2NA
B.常温常压下,11.2L氯气中所含的原子数目为NA
C.通常状况下,32g氧气所含有的原子数目为2NA
D.100ml 2mol·L-1的氯化钠溶液中含各离子数目之和为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中,配制溶液需要的是_________________(填字母),配制上述溶液还需用到的玻璃仪器是__________________________(填仪器名称)。

(2)根据计算用托盘天平称取NaOH的质量为_______________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_____________(填“大于”“等于”或“小于”)0.1 mol/L。 若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作:_______。
(3)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为________mL。如果实验室有10 mL,15 mL,20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________。
(4)下列操作会使配制的NaOH溶液浓度偏低的是___________。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol C2H2O4的质量是_______g,约含______个C2H2O4分子,含______mol氧原子。
(2)38.4g SO2在标准状况下的体积为___________L,该气体在标准状况下的密度是______________。
(3)在标准状况下,将_______L NH3溶于水得到0.5 mol·L-1的氨水250 mL;配制100 mL 0.2 mol·L-1CuSO4溶液,需要CuSO4·5H2O________g。
(4)液态化合物XY2在一定量O2中恰好完全燃烧(XY2(液)+ 3O2(气)= XO2(气)+ 2YO2(气)),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是___________mL。 ②化合物XY2的摩尔质量是___________。
③若XY2分子中X、Y两元素的质量之比为3:16,则X、Y两元素分别是_________和________。(写元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com