
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO 2(g)+O2(g)![]() 2SO3(g);△H=-190KJ·mol-1
2SO3(g);△H=-190KJ·mol-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO38g,则V(O2)= mol·L-1·min-1,计算此时化学平衡常数K1= 。
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为 (填 “>”、“<”或“=”)。
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<;左、右;增大、减小、不变)。
①达到平衡所需要的时间:t(A) t(B)
②平衡时,SO2的转化率:a(A) a(B)
③达到平衡时,在两容器中分别通入等量的Ar气。B中的化学平衡向 反应方向移动,A中的化学反应速率 。
【答案】(1)0.02;100 (每空2分) (2) 继续通入0.20mol SO2和0.10mol SO3,容器内压强增大,平衡向气体体积减小的方向移动;= (每空2分)(3) ①>; ②< ;③左;不变(每空1分)
【解析】
试题分析:(1)SO30.8g物质的量=0.8/80=0.01mol,三段法得:
2SO 2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
开始的量:0.2 0.1 0
转化的量:0.1 0.05 0.1
剩余的量:0.1 0.05 0.1
v(O2)=0.05/5/0.5=0.02molL-1min-1;K= c2(SO3)/(c2(SO2)c(O2))=(0.1/5)2/[(0.1/5)2(0.05/5)]=100。
(2)继续通入0.20mol SO2和0.10mol SO3,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;K只与温度有关,因为温度不变所以K1=K2。
(3))①由于该反应是体积减小的反应,恒压过程中的压强始终大于恒容过程中的,而压强大,速率大,所以有t(A)>t(B);②由于该反应是体积减小的反应,恒压过程中的压强始终大于恒容过程中的,而压强大,平衡向正反应方向移动,SO2的转化率:a(A)<a(B);③达到平衡时,在两容器中分别通入等量的Ar气,A中体积不变,所以各物质的浓度不变,所以化学反应速率不变,B的体积增大,各物质浓度减小,相当于减压,平衡向逆反应方向移动。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
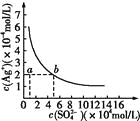
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
C. Ag2SO4的溶度积常数(Ksp)为1×10-3
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中,说法正确的是()
A.钠在空气中燃烧,发出黄色火焰B.钠在空气中燃烧,产物是Na2O
C.钠是银白色金属,硬度大,熔点高D.取用金属钠时,剩余的钠不能放回原瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中的离子,能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl﹣、OH﹣
B.H+、Ca2+、CO32﹣、NO3﹣
C.Cu2+、K+、SO42﹣、NO3﹣
D.Na+、H+、OH﹣、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在现代生产和日常生活中应用广泛。工业上用电解熔融氧化铝的方法来制取金属铝,纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。反应方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(1)在电解时阴极的电极反应式_________________,阳极的电极反应式_____________________。
(2)对金属制品进行抗腐蚀处理,可延长其使用寿命,以铝材为阳极,在H2SO4溶液中电解,可使铝材表面形成氧化膜,阳极电极反应式为________________________。在电解过程中,阴极附近溶液的pH________(填“增大,减小或不变”)
(3)“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2=2AlI3,该电池负极的电极反应为:_____________________________,当负极质量减少27g时,在导线有________个电子通过。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应式书写正确的是( )
A. 制取氢氧化铁胶体的化学方程式为FeCl3+3H2O![]() Fe(OH)↓+3HCl
Fe(OH)↓+3HCl
B. 亚硫酸在溶液中的电离方程式为H2SO3![]() 2H++SO32-
2H++SO32-
C. NaHCO3水解的离子方程式为HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. 泡沫灭火器工作原理离子方程式为Al3++3HCO3-=3CO2↑+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某烷烃完全燃烧后,生成的气体缓缓通过盛有0.5L 2mol / LNaOH溶液中,生成的 Na2CO3和NaHCO3的物质的量之比为1:3,则该烷烃为
A. 甲烷 B. 乙烷 C. 丙烷 D. 丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气中还是纯氧中都不会燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造空气(氧气与氦气的混合气)可用于减轻某些病痛或供深水潜水员使用。标准状况下,5.6 L“人造空气”的质量是2.4 g,其中氧气与氦气的质量比是( )
A. 1∶1 B. 2∶1 C. 1∶4 D. 2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com