
【题目】把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是( )
A. 该装置将化学能转变为电能
B. 电流从锌片流向铜片
C. 一段时间后,铜片质量减轻
D. 锌片发生还原反应
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵![]() 是一种重要的化学试剂,某兴趣小组在课本合成方案的基础上进行了改进,流程如下:
是一种重要的化学试剂,某兴趣小组在课本合成方案的基础上进行了改进,流程如下:

(1)下列说法正确的是_________。
A.废铁屑需用![]() 溶液除去表面的油污,通常采用抽滤除去碱液
溶液除去表面的油污,通常采用抽滤除去碱液
B.实验中使用的蒸馏水均需煮沸除氧
C.在加入硫酸铵前,应该把硫酸亚铁溶液的pH值控制在强酸性范围内
D.鉴定所得晶体中含有![]() ,可以取少量样品于试管中,加水溶解,加入NaOH溶液,露置于空气中,观察现象
,可以取少量样品于试管中,加水溶解,加入NaOH溶液,露置于空气中,观察现象

(2)废铁屑含有碳、硫、硅等杂质,为较快地制得较纯净的![]() ,该兴趣小组设计图甲装置来制备产品,并选用了以下试剂中的一部分来完成实验。
,该兴趣小组设计图甲装置来制备产品,并选用了以下试剂中的一部分来完成实验。
a.![]() 溶液 b.碳粉 c.
溶液 b.碳粉 c.![]() 溶液 e.
溶液 e.![]() 溶液 f.乙醇
溶液 f.乙醇
①在去油污后的废铁屑中加入一种物质,该物质可以为_________。
②在洗气瓶中装入一种物质,该物质可以为_________。
(3)步骤Ⅲ的具体操作:迅速取滤液置于容器中,沿器壁缓慢加入适量乙醇,使之覆盖在液面上,随着乙醇在溶液中不断扩散,硫酸亚铁铵逐渐结晶析出。该方法的优点是(写出至少两点)_________。
(4)制得![]() 后,需要对晶体进行干燥,课本用干净的滤纸吸干,该兴趣小组同学经过讨论,决定用减压干燥,装置如图乙所示。将产品放入干燥器后、用水泵抽至盖子推不动即可。干燥结束后,启盖前,必须__________________,然后启盖。
后,需要对晶体进行干燥,课本用干净的滤纸吸干,该兴趣小组同学经过讨论,决定用减压干燥,装置如图乙所示。将产品放入干燥器后、用水泵抽至盖子推不动即可。干燥结束后,启盖前,必须__________________,然后启盖。
(5)产品中铁含量的测定可以采用酸性高锰酸钾滴定的方法。高锰酸钾标准溶液可用性质稳定,摩尔质量较大的基准物质草酸钠进行标定,反应原理为:
![]() 。
。
实验步骤如下:
步骤一:先粗配浓度约为![]() 的高锰酸钾溶液250mL;
的高锰酸钾溶液250mL;
步骤二:称取草酸钠固体m g放入锥形瓶中,加入适量水溶解并加硫酸酸化,加热到![]() ,立即用
,立即用![]() 滴定,从而标定
滴定,从而标定![]() 浓度为
浓度为![]() ;
;
步骤三:称取样品2.031g,放入锥形瓶并用适量水溶解;
步骤四:用标准![]() 溶液滴定步骤三所配样品溶液,达到终点时消耗标准液45.00mL.
溶液滴定步骤三所配样品溶液,达到终点时消耗标准液45.00mL.
①步骤一中至少需要用到的玻璃仪器有烧杯、___________、___________。
②步骤二中需要对m的值进行预估,你的预估依据是____________。
a.所加硫酸的体积和浓度 b.反应的定量关系
c.滴定管的最大容量 d.用于溶解草酸钠的水的体积
③实验过程中需要进行多次滴定,在滴定步骤前要进行一系列操作,请选择合适的编号,按正确的顺序排列____________。
a.向酸式滴定管中间装入操作液至“0”刻度以上;
b.用蒸馏水洗涤滴定管;
c.将滴定管内装满水,直立于滴定管夹上约2min;
d.用操作溶液润洗滴定管;
e.将活塞旋转![]() 后,再次观察;
后,再次观察;
f.将滴定管直立于滴定管夹上,静置Ⅰ分钟左右,读数;
g.右手拿住滴定管使其倾斜![]() ,左手迅速打开活塞。
,左手迅速打开活塞。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物用途广泛,三盐基硫酸铅(3PbO·PbSO4·H2O,摩尔质量=990 g/mol)简称三盐。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。

已知:![]() 。
。
请回答下列问题:
(1)步骤①中涉及的主要反应的平衡常数K=____(列出计算式即可)。步骤②中滤渣的主要成分是____。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____(任答一条)。
(3)步骤⑥合成三盐的化学方程式为____。现用100 t铅泥可制得纯净干燥的三盐49.5 t,若铅元素的利用率为75%,则铅泥中铅元素的质量分数为___ %。简述步骤⑦检验沉淀洗涤完全的方法___ 。
(4)已知水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,其中Pb(OH)2是沉淀,各形态铅的物质的量的分数α随溶液pH变化的关系如图所示,除去污水中的铅,最好控制溶液的pH在____左右,当溶液的pH由13转化为14时发生反应的离子方程式是:________________

(5)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,进一步电解Na2PbCl4生成Pb,如图所示。阴极电极反应式是_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:
(1)该反应的生成物中含有的官能团的名称是_______________,只含该官能团的物质在一定条件下不能发生的反应有_________(填序号);
①加成反应 ②酯化反应 ③氧化反应 ④还原反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使![]() 分子中所有原子可能都在同一平面内,
分子中所有原子可能都在同一平面内,![]() 不能是_________(填序号);
不能是_________(填序号);
①![]() ②
②![]() ③
③![]()
(3)某氯代烃A的分子式为![]() ,它可以发生如下转化:
,它可以发生如下转化:

结构分析表明E分子中含有两个甲基且没有支链。
①A、C的结构简式分别为:A_______________,C_______________;
②写出下列转化的反应方程式:A→B:__________________,D→E:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下面是几种实验中常用的仪器:
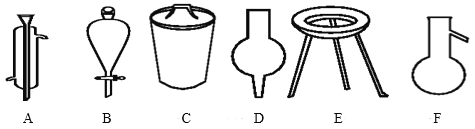
写出序号所代表的仪器的名称:
A__;B__;C__;D___;E___F___。
Ⅱ.实验室要配制100mL1mol/LNaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和___。
(2)用托盘天平称取氯化钠固体,其质量为___g。
(3)下列主要操作步骤的正确顺序是___(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒 ,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次 ,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度___(填“偏高"或“偏低"或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.5mol/(L·s)B. v(B)=0.3mol/(L·s)
C. v(C)=0.8mol/(L·s)D. v(D)=1.0mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Zn(s)+1/2O2(g)=ZnO(s) △H=-350.5kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s) △H=-90.8kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A. +519.4kJ·mol-1B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1D. -519.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
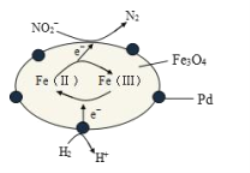
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com