
����Ŀ������ʯ�ͼ�ʽ̼����þ[MgaAlb��OH��c��CO3��dxH2O]�����������ж����ż�Ϊ��Ҫ��Ӧ�ã�ij�о�С���������ʯ��ȡ�������������ʣ��Լ���ʽ̼����þ�����չ���������о���������벢��ɶ��й�����Ľ��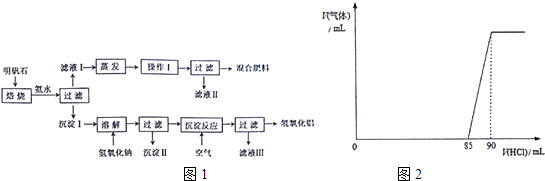
��1������ʯ����ȡ���ʺ�������������Ҫԭ�ϣ�����ʯ����ɺ��������ƣ�����������������������������ʣ�����ʵ�鲽����ͼ1��ʾ���ٲ���I������Ϊ
�ڻ�Ϸ��ϵ���Ҫ�ɷ�����д��ѧʽ����������Һ�����Ƿ���NH4+�ķ����ǣ�ȡ�ٻ���Һ�����Թ��У������м���������NaOH��Һ�����ȣ������������ܹ�ʹ �� ��֤����Һ���к���NH4+
��һ�������£����������������������Ӧ����������ĸ��
a��KSCN��Һ b��Al c��NaOH ��Һ
�ܿ����ܹ�Ϊ������Ӧ�ṩ��������д��ѧʽ����
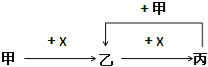
��2����ʽ̼����þ�dz���θҩ����ϲ������Ҫ�ɷ֣�Ϊȷ����ʽ̼����þ����ɣ�����������ʵ�飺��ȡ��ʽ̼����þ��ĩ6.02g����������2.0molL��1����ʹ���ֻ�Ϸ�Ӧ����Ӧ�����в�����������V�����壩��������������V��HC1���Ĺ�ϵ��ͼ2��ʾ�����ʽ̼����þ����������̼��������ʵ���֮��Ϊ
�ڽ��ٷ�Ӧ��õ��Ļ��Һ�ٺ���������������Һ��ֻ�ϣ���Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48g�����ʽ̼����þ�Ļ�ѧʽΪ ��
���𰸡�
��1����ȴ�ᾧ��K2SO4����NH4��2SO4��ʪ��ĺ�ɫʯ����ֽ������b��CO2
��2��16��1��Mg6Al2��OH��16CO3?4H2O
���������⣺��1������ʯ����Al2O3��Fe2O3�����ʣ���������ϡ��ˮ������ʯ�е��������백ˮ��Ӧ�����˺����I�к�Al2O3��Fe2O3��Al��OH��3 �� ��ҺI�к������ӡ�笠����ӡ���������ӣ���Һ��������Ũ������ȴ�ᾧ�����˵õ�����ء�����茶��壮Al2O3��Fe2O3��Al��OH��3�м����������ƣ�Fe2O3���������Ʋ���Ӧ��Al2O3�������������������Ʒ�Ӧ��Al��OH��3+NaOH�TNaAlO2+2H2O��Al2O3+2NaOH�T2NaAlO2+H2O����Һ�к���NaAlO2��Һ��������Ϊ����������Һ��ͨ�������Ŀ�����������Ӧ��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3 �� �ٹ��˵õ�������������Һ���к���NaHCO3 �� �ٲ���I�Ǵ���Һ�л�þ��壬��Ҫ�ṹ����Ũ������ȴ�ᾧ�����˵Ȳ������ʴ�Ϊ����ȴ�ᾧ����������������֪����Ϸ��ϵ���Ҫ�ɷ���K2SO4����NH4��2SO4 �� ������Һ�����Ƿ���NH4+�ķ����ǣ�ȡ�ٻ���Һ�����Թ��У������м���������NaOH��Һ�����ȣ������������ܹ�ʹʪ��ĺ�ɫʯ����ֽ��������֤����Һ���к���NH4+ �� �ʴ�Ϊ��K2SO4����NH4��2SO4��ʪ��ĺ�ɫʯ����ֽ�������۳�����Ϊ��������Al�����������������ȷ�Ӧ����ѡ��b���ܿ����ܹ�Ϊ������Ӧ�ṩ�����ģ�CO2 �� �ʴ�Ϊ��CO2����2���ټ������ᣬ��һ�η�Ӧ����Ϊ��OH��+H+=H2O��CO32��+H+=HCO3������������ķ�Ӧ����Ϊ��HCO3��+H+=CO2��+H2O�����ɶ�����̼�������ᣨ90��85��mL=5mL����n��CO32����=n��HCO3����=0.005L��2mol/L=0.01mol����n��OH����=0.085L��2mol/L��0.01mol=0.16mol�������ʽ̼����þ��n��OH������n��CO32����=0.16mol��0.01mol=16��1���ʴ�Ϊ��16��1���ڼ������������������Һ����Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48gΪ������þ����������n[Mg��OH��2]= ![]() =0.06mol����ϲ��n��Mg2+��=n[Mg��OH��2]=0.06mol�����õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������3n��Al3+��=0.16mol+0.01mol��2��0.06mol��2=0.06mol����n��Al3+��=0.02mol���ʣ�m��CO32����=0.01 mol��60 gmol��1=0.6 g m��OH����=0.16 mol��17 gmol��1=2.72 gm��Mg2+��=0.06 mol��24 gmol��1=1.44 gm��Al3+��=0.02 mol��27 gmol��1=0.54 g���ԣ�m��H2O��=6.02g��0.6g��2.72g��1.44g��0.54g=0.72g����n��H2O��=
=0.06mol����ϲ��n��Mg2+��=n[Mg��OH��2]=0.06mol�����õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������3n��Al3+��=0.16mol+0.01mol��2��0.06mol��2=0.06mol����n��Al3+��=0.02mol���ʣ�m��CO32����=0.01 mol��60 gmol��1=0.6 g m��OH����=0.16 mol��17 gmol��1=2.72 gm��Mg2+��=0.06 mol��24 gmol��1=1.44 gm��Al3+��=0.02 mol��27 gmol��1=0.54 g���ԣ�m��H2O��=6.02g��0.6g��2.72g��1.44g��0.54g=0.72g����n��H2O��= ![]() =0.04 mol��n��Mg2+����n��Al3+����n��OH������n��CO32������n��H2O��=0.02��0.06��0.16��0.01��0.04=6��2��16��1��4����ϲ�����ΪMg6Al2��OH��16CO34H2O���ʴ�Ϊ��Mg6Al2��OH��16CO34H2O��
=0.04 mol��n��Mg2+����n��Al3+����n��OH������n��CO32������n��H2O��=0.02��0.06��0.16��0.01��0.04=6��2��16��1��4����ϲ�����ΪMg6Al2��OH��16CO34H2O���ʴ�Ϊ��Mg6Al2��OH��16CO34H2O��
��1������ʯ����Al2O3��Fe2O3�����ʣ���������ϡ��ˮ������ʯ�е��������백ˮ��Ӧ�����˺����I�к�Al2O3��Fe2O3��Al��OH��3 �� ��ҺI�к������ӡ�笠����ӡ���������ӣ���Һ��������Ũ������ȴ�ᾧ�����˵õ�����ء�����茶��壮Al2O3��Fe2O3��Al��OH��3�м����������ƣ�Fe2O3���������Ʋ���Ӧ��Al2O3�������������������Ʒ�Ӧ��Al��OH��3+NaOH�TNaAlO2+2H2O��Al2O3+2NaOH�T2NaAlO2+H2O����Һ�к���NaAlO2��Һ��������Ϊ����������Һ��ͨ�������Ŀ�����������Ӧ��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3 �� �ٹ��˵õ�������������Һ���к���NaHCO3 �� ��2���ټ������ᣬ��һ�η�Ӧ����Ϊ��OH��+H+=H2O��CO32��+H+=HCO3������������ķ�Ӧ����Ϊ��HCO3��+H+=CO2��+H2O����������������n��OH������n��CO32�������ڼ������������������Һ����Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48gΪ������þ������������n= ![]() ����n[Mg��OH��2]����ϲ��n��Mg2+��=n[Mg��OH��2]�����õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������n��Al3+�������ݽ����Ʒ�������ˮ���������ٸ��ݸ���n=
����n[Mg��OH��2]����ϲ��n��Mg2+��=n[Mg��OH��2]�����õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������n��Al3+�������ݽ����Ʒ�������ˮ���������ٸ��ݸ���n= ![]() ����n��H2O�����ݴ�ȷ��n��Mg2+����n��Al3+����n��OH������n��CO32������n��H2O�����ݴ���д��ѧʽ��
����n��H2O�����ݴ�ȷ��n��Mg2+����n��Al3+����n��OH������n��CO32������n��H2O�����ݴ���д��ѧʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
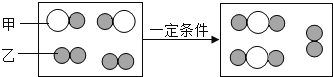
����Ŀ����֪�ס��ҡ�����X��������ѧ��ѧ�г��������ʣ���ת����ϵ��ͼ��ʾ�����X�������ǣ� ��
A. ��ΪC��XΪO2 B. ��ΪSO2��XΪNaOH��Һ
C. ��ΪFe��XΪCl2 D. ��ΪAlCl3��XΪNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������غ㶨�ɵĶ����о��Ի�ѧ��ѧ��չ�����ش����塣
��1����ͼΪij��ѧ��Ӧ����ģ��ͼ�����𡱺͡�![]() ���ֱ��ʾ���ֲ�ͬ��ԭ�ӣ�
���ֱ��ʾ���ֲ�ͬ��ԭ�ӣ�
�����ס�![]() ���ۼ��ɵ�����______������ܡ������ܡ�����������μӷ�Ӧ�ļס������ַ�Ӧ����ӵĸ�����Ϊ______���˷�Ӧ�Ļ�����Ӧ����Ϊ______���ξ�һ�����ϴ˷�Ӧ���͵Ļ�ѧ����ʽ______��
���ۼ��ɵ�����______������ܡ������ܡ�����������μӷ�Ӧ�ļס������ַ�Ӧ����ӵĸ�����Ϊ______���˷�Ӧ�Ļ�����Ӧ����Ϊ______���ξ�һ�����ϴ˷�Ӧ���͵Ļ�ѧ����ʽ______��
��2����m1gþ�����ڿ�������ȫȼ�գ�ͨ�������֪����������þm2g��ֻ�����������ķ�Ӧ����ͬ������m1______m2������ڻ�С�ڻ���ڣ���С��ͬѧ������ʵ��ʱ���۲쵽ҫ�۵İ⣬ð���������̣���������ʱ������m1��m2����ԭ�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. ������һ�����н���Ԫ��, ������һ��ֻ���зǽ���Ԫ��
B. ij����Ԫ�ص������Ӻ�ij�ǽ���Ԫ�ص���������ɵ�����һ���Ǵ�����
C. ȫ���ɷǽ�����ɵĻ�����һ���ǹ��ۻ�����
D. �����ز����ܴ��ε�ˮ��Һ���û�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��þʯ����Ҫ�ɷ�ΪMgCl26H2O��Ϊԭ��������ʽ̼��þ[Mgx��CO3��y��OH��zwH2O]����Ҫ������ͼ��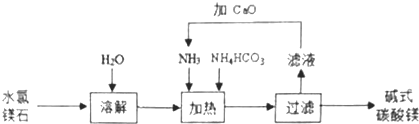
��1�����������У���Һ�����ʵ���Ҫ�ɷ���д��ѧʽ��������Һ�м���CaO��Ŀ���� ��
��2�����������У����顰���ˡ����ʽ̼��þ��ϴ�Ӹɾ��ķ����� ��
��3����֪�������ռ�ʽ̼��þ�ɵõ�MgO��ȡ��ʽ̼��þ4.66g���������������أ��õ�����2.00g�ͱ�״����CO20.896L��ͨ������ȷ����ʽ̼��þ�Ļ�ѧʽ��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ��ͼ��ʾ��������������������ȥ����A��C��E��G����ѧ��ѧ�г����ĵ��ʣ�ͨ��״���£�E���ܶ���С�����壬G�ǻ���ɫ�����壬B �dz�������ɫҺ�壬FΪǿ�D��ij�־��д��ԵĽ����������Ҫ�ɷ֣�K���ȷֽ�����ɺ���ɫ���壮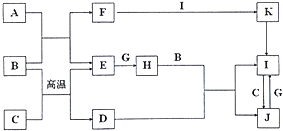
��ش��������⣺
��1��D�Ļ�ѧʽΪ
��2��H�ĵ���ʽΪ
��3��д��A��B��Ӧ�Ļ�ѧ����ʽ��
��4��д��������G��F����Һ��Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mL 0.5 mol��L-1�Ĵ�����Һ����μ�������ʵ���Ũ�ȵ��ռ���Һ,�ⶨ�����Һ���¶ȱ仯��ͼ��ʾ�����й��ڻ����Һ�����˵���д������

A. ����ĵ���ƽ�ⳣ��:B��>A��
B. ��ˮ�������c(OH-):B��>C��
C. ��A�㵽B��,�����Һ�п��ܴ���:c(CH3COO-)=c(Na+)
D. ��B�㵽C��,�����Һ��һֱ����:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com