
【题目】以水氯镁石(主要成分为MgCl26H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)zwH2O]的主要流程如图: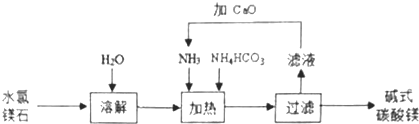
(1)上述流程中,滤液中溶质的主要成分(写化学式),向滤液中加入CaO的目的是 .
(2)上述流程中,检验“过滤”后碱式碳酸镁已洗涤干净的方法是 .
(3)已知高温煅烧碱式碳酸镁可得到MgO,取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L.通过计算确定碱式碳酸镁的化学式(写出计算过程)。
【答案】
(1)NH4Cl;与滤液中NH4Cl反应产生NH3循环使用
(2)取最后一次洗涤液适量于试管中,滴加AgNO3溶液,若无白色浑浊出现,则证明已洗涤干净
(3)n(Mg2+)=n(MgO)= ![]() =0.05mol,n(CO32﹣)=n(CO2)=
=0.05mol,n(CO32﹣)=n(CO2)= ![]() =0.04mol,根据化合物中电荷守恒计算:n(OH﹣)=0.05mol×2﹣0.04mol×2=0.02mol, m(H2O)=4.66g﹣2.00g﹣0.04mol×44g/mol=0.9g, n(H2O)=
=0.04mol,根据化合物中电荷守恒计算:n(OH﹣)=0.05mol×2﹣0.04mol×2=0.02mol, m(H2O)=4.66g﹣2.00g﹣0.04mol×44g/mol=0.9g, n(H2O)= ![]() =0.05mol,结晶水的物质的量:n(H2O)═0.05mol﹣
=0.05mol,结晶水的物质的量:n(H2O)═0.05mol﹣ ![]() =0.04mol,
=0.04mol,
则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4碱式碳酸镁的化学式为:Mg5(CO3)4(OH)24H2O
【解析】解:以水氯镁石(主要成分为MgCl26H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)zwH2O],水溶解后得到氯化镁溶液,向氯化镁溶液中加入氨气、碳酸氢铵,加热,反应能生成碱式碳酸镁和氯化铵,过滤后滤液的主要溶质是氯化铵,铵根离子能和显碱性的物质反应生成氨气,氧化钙能和水反应生成显碱性的氢氧化钙溶液,可以用氧化钙和水反应生成的氢氧化钙,结合铵根离子生成氨气循环使用,(1)上述流程中,滤液中溶质的主要成分是NH4Cl,向滤液中加入CaO的目的是与滤液中NH4Cl 反应产生NH3循环使用,所以答案是:NH4Cl,与滤液中NH4Cl 反应产生NH3循环使用;(2)检验最后一次洗涤液中是否含有氯离子,可以加入硝酸银溶液观察是否生成白色沉淀,实验设计为:取最后一次洗涤液适量于试管中,滴加AgNO3溶液,若无白色浑浊出现,则证明已洗涤干净,所以答案是:取最后一次洗涤液适量于试管中,滴加AgNO3溶液,若无白色浑浊出现,则证明已洗涤干净;(3)n(Mg2+)=n(MgO)= ![]() =0.05 mol,n(CO32﹣)=n(CO2)=
=0.05 mol,n(CO32﹣)=n(CO2)= ![]() =0.04 mol,根据化合物中元素化合价代数和为零 n(OH﹣)=0.05 mol×2﹣0.04 mol×2=0.02mol, m (H2O)=4.66g﹣2.00g﹣0.04 mol×44 g/mol=0.9 g, n(H2O)=
=0.04 mol,根据化合物中元素化合价代数和为零 n(OH﹣)=0.05 mol×2﹣0.04 mol×2=0.02mol, m (H2O)=4.66g﹣2.00g﹣0.04 mol×44 g/mol=0.9 g, n(H2O)= ![]() =0.05 mol,结晶水的物质的量:n(H2O)═0.05 mol﹣
=0.05 mol,结晶水的物质的量:n(H2O)═0.05 mol﹣ ![]() =0.04 mol,则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4碱式碳酸镁的化学式为:Mg5(CO3)4(OH)24H2O,所以答案是:n(Mg2+)=n(MgO)=
=0.04 mol,则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4碱式碳酸镁的化学式为:Mg5(CO3)4(OH)24H2O,所以答案是:n(Mg2+)=n(MgO)= ![]() =0.05 mol,n(CO32﹣)=n(CO2)=
=0.05 mol,n(CO32﹣)=n(CO2)= ![]() =0.04 mol,根据化合物中元素化合价代数和为零 n(OH﹣)=0.05 mol×2﹣0.04 mol×2=0.02mol, m (H2O)=4.66g﹣2.00g﹣0.04 mol×44 g/mol=0.9 g, n(H2O)=
=0.04 mol,根据化合物中元素化合价代数和为零 n(OH﹣)=0.05 mol×2﹣0.04 mol×2=0.02mol, m (H2O)=4.66g﹣2.00g﹣0.04 mol×44 g/mol=0.9 g, n(H2O)= ![]() =0.05 mol,结晶水的物质的量:n(H2O)═0.05 mol﹣
=0.05 mol,结晶水的物质的量:n(H2O)═0.05 mol﹣ ![]() =0.04 mol,则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4碱式碳酸镁的化学式为:Mg5(CO3)4(OH)24H2O.
=0.04 mol,则得x:y:z:w=0.05:0.04:0.02:0.04=5:4:2:4碱式碳酸镁的化学式为:Mg5(CO3)4(OH)24H2O.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验: 
根据实验所得数据,下列说法不正确的是( )
A.原混合物中铜元素的质量一定为0.64g
B.生成气体体积为2.016L
C.实验中反应的硫酸的物质的量为0.1mol
D.原混合物中铁的质量分数为87.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B. 用铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D. 用FeCl3溶液腐蚀印刷电路板上铜箱:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石和碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]在生产生活中都有着极为重要的应用.某研究小组对用明矾石制取氢氧化铝等物质,以及碱式碳酸铝镁的组成展开了如下研究,请你参与并完成对有关问题的解答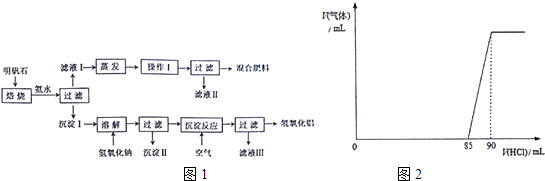
(1)明矾石是制取化肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图1所示:①操作I的名称为
②混合肥料的主要成分是(写化学式).检验滤液Ⅱ中是否含有NH4+的方法是:取少货滤液Ⅱ于试管中,向其中加入适量的NaOH溶液,加热,若产生气体能够使 , 则证明滤液Ⅱ中含有NH4+
③一定条件下,下列物质能与沉淀Ⅱ发生反应的是(填字母)
a.KSCN溶液 b.Al c.NaOH 溶液
④空气能够为沉淀反应提供足量的(写化学式).
(2)碱式碳酸铝镁是常见胃药“达喜”的主要成分.为确定碱式碳酸铝镁的组成,进行了如下实验:①取碱式碳酸铝镁粉末6.02g,缓缓加入2.0molL﹣1盐酸使其充分混合反应,反应过程中产生气体的体积V(气体)和消耗盐酸的体积V(HC1)的关系如图2所示,则碱式碳酸铝镁中氢氧根与碳酸根的物质的量之比为
②将①反应后得到的混合液再和过量的氢氧化钠溶液充分混合,反应完全后经过过滤、洗涤、干燥得沉淀3.48g,则碱式碳酸铝镁的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下产生某气体并检验其性质的相关实验,请完成下列问题:
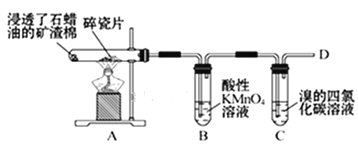
(1)A中产生的气体是___________(填名称),该物质的结构式__________________________;
(2)B中实验现象:_____________________,原因是:__________________________________;
(3)C中发生反应的化学方程式:_________________________________,反应类型:______________ ;
(4)在D处点燃时必须进行的操作_________________________________;
(5)下列说法正确的是(_______)
A.聚乙烯塑料可以用做食品袋、餐具和地膜
B.乙烯分子中所有原子不共面
C.高锰酸钾溶液浸泡过的硅藻土可以保鲜水果
D.乙烯是一种植物生产调节剂,可以延长果实和花朵的成熟期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com