
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验: 
根据实验所得数据,下列说法不正确的是( )
A.原混合物中铜元素的质量一定为0.64g
B.生成气体体积为2.016L
C.实验中反应的硫酸的物质的量为0.1mol
D.原混合物中铁的质量分数为87.5%
【答案】B
【解析】解:生成可燃性气体,说明发生反应Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,生成0.64gCu,其物质的量: ![]() =0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.40g﹣0.8g=5.6g,n(Fe)= ![]() =0.1mol,
=0.1mol,
A.根据分析可知,铜的质量为0.64g,故A正确;
B.设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,没有告诉在标准状况下,不能使用标准状况下气体摩尔体积计算氢气体积,故B错误;
C.铁的物质的量为0.1mol,反应生成溶质为硫酸亚铁,则反应消耗的硫酸的物质的量为0.1mol,故C正确;
D.由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为: ![]() ×100%=87.5%,故D正确;
×100%=87.5%,故D正确;
故选B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | KOH | HNO3 | CaCO3 | CaO | Mn2O7 |
D | NaOH | HCl | CaF2 | Na2O2 | SO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ①④⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)下图为某化学反应的微观模拟图,“○”和“![]() ”分别表示两种不同的原子:
”分别表示两种不同的原子:
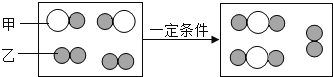
由微粒甲“![]() ”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______。
”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______。
(2)把m1g镁带放在空气中完全燃烧,通过计算可知,生成氧化镁m2g(只考虑与氧气的反应,下同),则m1______m2(填大于或小于或等于)。小嘉同学在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因可能是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 阳离子一定含有金属元素, 阴离子一定只含有非金属元素
B. 某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C. 全部由非金属组成的化合物一定是共价化合物
D. 金属钾不可能从盐的水溶液中置换出金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水氯镁石(主要成分为MgCl26H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)zwH2O]的主要流程如图: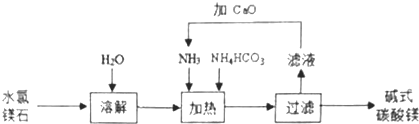
(1)上述流程中,滤液中溶质的主要成分(写化学式),向滤液中加入CaO的目的是 .
(2)上述流程中,检验“过滤”后碱式碳酸镁已洗涤干净的方法是 .
(3)已知高温煅烧碱式碳酸镁可得到MgO,取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L.通过计算确定碱式碳酸镁的化学式(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com