
【题目】根据下表部分短周期元素信息,判断以下叙述正确的是( )

A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的剧烈程度L<Q
C. M与T形成的化合物具有两性 D. L2+与R2﹣的核外电子数相等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是
A. NO B. NO2 C. N2O D. NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
I.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 =______(用含ΔH1 、ΔH2 的代表式表示)。
II.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS_____0(填“>”、“=”、“<”),该反应的ΔH____0(填“>”、“<”)。
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,温度T下,CO2物质的量浓度c(CO2)随时间t变化的曲线如下图所示。下列能说明反应达到平衡状态的是___。
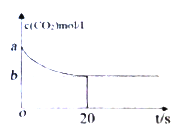
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)温度T下,反应前20秒的平均速率v(H2)= _________(用含a、b的代数式表示)。
(4)温度T下,该反应的平衡常数K=_________(用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)_________;CO2转化率_________(填“增大”“减小”或“不变”)。
III.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括_________和H++HCO3-=CO2↑+H2O。
②简述CO32-在阴极区再生的原理:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量Mg与2.8gN2完全反应后失去0.2NA电子
B. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
C. 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA
D. 16gO2含有NA个18O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用同一原理解释的是:
A. SO2和Cl2都能用于漂白
B. I2、NH4Cl晶体受热都逐渐消失
C. 配制Fe(NO3)3和Sn(NO3)2溶液均要加入稀硝酸
D. SO2可使加酚酞的氢氧化钠溶液和酸性高锰酸钾溶液的红色都褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项说法正确的是( )
A. “84”消毒液的有效成分是NaClO
B. SO2具有漂白性,可用于加工食品,使食品增白
C. 可以用酒精萃取碘水中碘单质
D. SO2气体通入Ba(NO3)2溶液中不能产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性燃料电池(以甲醇为燃料,酸性介质)结构示意如图。下列有关说法正确的是
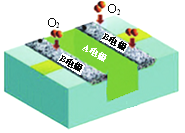
A. 电池工作时,电子由A电极经外电路流向B电极
B. 电池工作时,减少的化学能完全转化为电能
C. A电极发生的电极反应为:CH3OH-6e-+H2O=CO2+6H+
D. B电极每消耗1 mol O2,电池中减少4 mol H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护等密切相关。下列做法不正确的是
A. 推广使用电动汽车低碳交通工具
B. 用CO2合成可降解的聚碳酸酯塑料
C. 用生物方法脱除生活污水中的氮和磷
D. 加大铅酸蓄电池、含汞锌锰等电池的生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1. 0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据述数据,回答下列问题 :
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为________ 。
(2)在实验1中,c1数值为 ________ 。
(3)在实验1、2中有一个实验使用了正催化剂。判断是实验 ________ (选填“1”或“2”)使用了正催化剂。
(4)在实验1、3中反应温度不同。判断T3 ________ 800(选填“﹤”或“﹥”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com