
【题目】有以下一系列反应,最终产物是乙二酸。
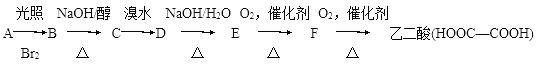
试回答下列问题:
(1)C的结构简式是________。B―→C的反应类型是________。
(2)E―→F的化学方程式是__________
(3)E与乙二酸发生酯化反应生成环状化合物的化学方程式是___________。
(4)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是_______。
【答案】CH2===CH2 消去反应 HOCH2-CH2OH+O2 HOOC-COOH+2H2O HOCH2-CH2OH+HOOC-COOH
HOOC-COOH+2H2O HOCH2-CH2OH+HOOC-COOH![]()
 +2 H2O 乙二酸>苯酚>水>G(乙醇)
+2 H2O 乙二酸>苯酚>水>G(乙醇)
【解析】
根据流程图可知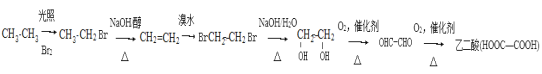 。
。
(1)根据流程图,C是乙烯,乙烯的结构简式是CH2===CH2。![]() 在氢氧化钠的醇溶液中生成CH2===CH2,反应类型是消去反应。
在氢氧化钠的醇溶液中生成CH2===CH2,反应类型是消去反应。
(2)乙二醇被氧化为乙二醛的化学方程式是HOCH2-CH2OH+O2 HOOC-COOH+2H2O;
HOOC-COOH+2H2O;
(3)E是乙二醇与乙二酸发生酯化反应生成环状化合物和水,化学方程式是HOCH2-CH2OH+HOOC-COOH![]()
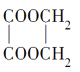 +2H2O。
+2H2O。
(4)由溴乙烷发生水解反应或乙烯与H2O发生加成反应均生成乙醇。羟基上氢原子的活泼性由强到弱的顺序是羧基>酚羟基>水>醇羟基。在乙二酸、水、苯酚、乙醇四种分子中,羟基上氢原子的活泼性由强到弱的顺序是乙二酸>苯酚>水>乙醇。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A. 500mL2mol·L-1 FeCl3溶液中Cl-数目为3NA,且n(Cl-)/n(Fe3+)=3
B. 电解法精炼铜,阴极析出1 mol Cu时,阳极失去的电子数为2NA
C. 64gSO2与足量的O2在一定条件下反应生成的SO3分子数目为NA
D. 在标准状况下,2.24LNH3通入水中制成氨水,溶液中NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:磷酸氯喹是治疗新型肺炎的潜力药。磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。回答下列问题

(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图

①该反应的化学方程式为___________(A用化学式表示)
②前10s的平均反应速率v(Cl2)=_______
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是___________(写名称)
②A与热水反应的化学方程式为____________。
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图______________,并作相应标注(标明正负极材料及电解质溶液的名称,电子移动方向、离子移动方向)。
(2)该装置中负极的电极方程式为________。
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() 。下列说法错误的是
。下列说法错误的是
A.上述反应属于加成反应
B.碳酸亚乙酯的二氯代物只有两种
C.碳酸亚乙酯中的所有原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的N2(g)和02(g)反应生成NO(g)过程中的能量变化情况判断,下列说法正确的是

A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2 mol O原子结合生成O2(g)时需要吸收498 kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量
D.2 mol N(g)和2 mol O(g)的总能量为1444 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示:
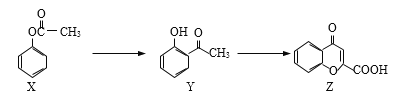
下列有关叙述正确的是
A. 三种物质中都含有羰基
B. 等物质的量的Y、Z能和含有等物质的量的NaOH的溶液反应
C. 可用NaHCO3溶液鉴别三种物质
D. 1 mol Z跟足量O2反应,最多消耗10 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。依据氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+设计的原电池如图所示。
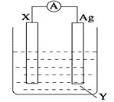
(1)电极X的材料是__;电解质溶液Y是__。
(2)Ag电极上发生的反应为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,K接N,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为 g,石墨极上产生的物质的物质的量为 mol。

A.3.2 0.05B.0.05 3.2C.3.2 3.2D.0.05 0.05
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com