
【题目】I:磷酸氯喹是治疗新型肺炎的潜力药。磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。回答下列问题

(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图

①该反应的化学方程式为___________(A用化学式表示)
②前10s的平均反应速率v(Cl2)=_______
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是___________(写名称)
②A与热水反应的化学方程式为____________。
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图______________,并作相应标注(标明正负极材料及电解质溶液的名称,电子移动方向、离子移动方向)。
(2)该装置中负极的电极方程式为________。
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子__________mol。
【答案】2P+5Cl2=2PCl5 0.5mol/(Ls) 盐酸 PCl5+4H2O![]() H3PO4+5HCl
H3PO4+5HCl 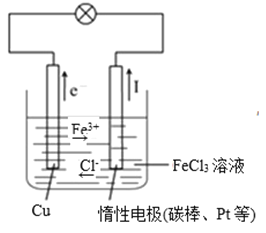 Cu-2e-=Cu2+ 0.1
Cu-2e-=Cu2+ 0.1
【解析】
I.合成磷酸的流程分析如下:红磷和氯气反应生成PCl5,PCl5再与水反应生成磷酸和盐酸;
II.将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,根据原电池的构成条件,应用铜作负极,正极比铜更稳定,如惰性电极,电解质为FeCl3溶液。
I(1)①A为PCl5,反应的化学方程式为2P+5Cl2=2PCl5,故答案为:2P+5Cl2=2PCl5;
②前10s的平均反应速率v(Cl2)=![]() =
= ![]() =0.5mol/(Ls),故答案为:0.5mol/(Ls);
=0.5mol/(Ls),故答案为:0.5mol/(Ls);
(2)①由上述分析可知,另一种是酸C是盐酸,故答案为:盐酸;
②PCl5与足量水充分反应,最终生成两种酸:磷酸和盐酸,由原子守恒可知化学方程式为PCl5+4H2O![]() H3PO4+5HCl,故答案为:PCl5+4H2O
H3PO4+5HCl,故答案为:PCl5+4H2O![]() H3PO4+5HCl;
H3PO4+5HCl;
II(1)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,则正极可为惰性电极,电解质溶液为氯化铁,装置示意图为: ,故答案为:
,故答案为: ;
;
(2)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)减轻的电极为Cu,电极减轻3.2g,则铜反应掉的物质的量为:![]() =0.05mol,则在导线中通过电子0.05mol
=0.05mol,则在导线中通过电子0.05mol![]() mol=0.1mol,故答案为:0.1。
mol=0.1mol,故答案为:0.1。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.2.1gDTO中含有的质子数为NA
B.30g葡萄糖和冰醋酸的混合物中含有的氢原子数为4NA
C.12g石墨烯(单层石墨)中含有六元环的个数为2NA
D.1mol铁在一定条件下分别和氧气、氯气、硫完全反应转移电子数都为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中每个原子均满足8电子结构。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )
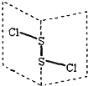
A. S2Cl2中的硫元素显+1价
B. S2Cl2中含极性键和非极性键,是非极性分子
C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D. S2Cl2与H2O反应的生成物中可能有S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。
已知:①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③Q、X原子p能级的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是___;基态Q原子的价电子排布图为_____。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是____(填字母)。
a.稳定性:甲>乙 b.沸点:甲<乙
(3)Q、R、X三种元素的第一电离能数值由小至大的顺序为_____(用元素符号作答)。
(4)五种元素中,电负性最大的非金属元素是___,电负性最小的非金属元素是___。(用元素符号作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物是乙二酸。
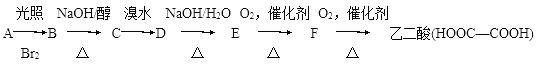
试回答下列问题:
(1)C的结构简式是________。B―→C的反应类型是________。
(2)E―→F的化学方程式是__________
(3)E与乙二酸发生酯化反应生成环状化合物的化学方程式是___________。
(4)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. CH3CH(C2H5)CH2CH(CH3)CH3的名称为2-甲基-4-乙基戊烷
B. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
C. 分子式为C5H10O2的能够发生水解反应和银镜反应的有机物有8种
D. 淀粉和蛋白质水解的最终产物都只有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com