
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
【答案】89.3 40% 3.56×104 BD CD Fe电极 Fe+2![]()
![]()
 +H2↑(Fe+2C5H6
+H2↑(Fe+2C5H6![]() Fe(C5H5)2+H2↑) 水会阻碍中间物Na的生成;水会电解生成OH,进一步与Fe2+反应生成Fe(OH)2
Fe(C5H5)2+H2↑) 水会阻碍中间物Na的生成;水会电解生成OH,进一步与Fe2+反应生成Fe(OH)2
【解析】
(1)利用盖斯定律解题;
(2)利用差量法计算转化率;三行式法计算平衡常数;根据平衡移动原理解释;
(3)通过外界因素对速率的影响和平衡状态的形成分析A、B、C选项,D选项观察图象计算;
(4)根据阳极:升失氧;阴极:降得还进行分析确定阴阳极;根据题干信息中Na元素的变化确定环戊二烯得电子数和还原产物,进而写出电极反应式;注意Na与水会反应,Fe2+在碱性条件下生成沉淀。
(1)根据盖斯定律①-②,可得反应③的ΔH=89.3kJ/mol;
答案:89.3;
(2)假设反应前碘单质与环戊烯均为nmol,平衡时环戊烯反应了xmol,根据题意可知;
![]() (g)+I2(g)=
(g)+I2(g)= ![]() (g)+2HI(g) 增加的物质的量
(g)+2HI(g) 增加的物质的量
1mol 1mol 1mol 2mol 1mol
xmol 2n×20%
得x=0.4nmol,转化率为0.4n/n×100%=40%;
![]() (g) + I2(g)=
(g) + I2(g)= ![]() (g)+ 2HI(g)
(g)+ 2HI(g)
P(初) 0.5×105 0.5×105 0 0
ΔP 0.5×105×40% 0.5×105×40% 0.5×105×40% 1×105×40%
P(平) 0.3×105 0.3×105 0.2×105 0.4×105
Kp=![]() =3.56×104;
=3.56×104;
A.T、V一定,通入惰性气体,由于对反应物和生成物浓度无影响,速率不变,平衡不移动,故A错误;
B.升高温度,平衡向吸热方向移动,环戊烯转化率升高,故B正确;
C.增加环戊烯的浓度平衡正向移动,但环戊烯转化率降低,故C错误;
D,增加I2的浓度,平衡正向移动,环戊烯转化率升高,故D正确;
答案:40%;3.56×104;BD;
(3)A.温度越高化学反应速率越快,单位时间内反应物浓度减少越多,则T1<T2,故A错误;
B.温度越高化学反应速率越快,因此a点反应速率大于c点反应速率,故B错误;
C. a点、b点反应一直在正向进行,故v(正)>v(逆),a点反应物浓度大于b点,故a点正反应速率大于b点,故C正确;
D.b点时环戊二烯浓度由1.5mol/L减小到0.6mol/L,减少了0.9mol/L,因此生成二聚体0.45mol/L,故D正确;
答案:CD;
(4)根据阳极升失氧可知Fe为阳极;根据题干信息Fe-2e-=Fe2+,电解液中钠离子起到催化剂的作用使得环戊二烯得电子生成氢气,同时与亚铁离子结合生成二茂铁,故电极反应式为Fe+2![]() =
=![]() +H2↑;电解必须在无水条件下进行,因为中间产物Na会与水反应生成氢氧化钠和氢气,亚铁离子会和氢氧根离子结合生成沉淀;
+H2↑;电解必须在无水条件下进行,因为中间产物Na会与水反应生成氢氧化钠和氢气,亚铁离子会和氢氧根离子结合生成沉淀;
答案:Fe电极;Fe+2![]() =
=![]() +H2↑(Fe+2C5H6=Fe(C2H5)2+ H2↑);水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2。
+H2↑(Fe+2C5H6=Fe(C2H5)2+ H2↑);水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ) ![]() 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:

(1)图中A、C分别表示:_____________、____________。E的大小对该反应的反应热有无影响?_____________ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是____________________________ 。
(2)图中ΔH=________kJ/mol。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:___________________
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。
(1)A的元素符号是____。
(2)B的氢化物与E的氢化物相比,较稳定的是___(填化学式)。
(3)C、E组成的化合物的电子式是___,其中所含化学键的类型是___。
(4)B、D、E按原子半径由大到小的顺序排列为___(填元素符号)。
(5)C的最高价氧化物对应的水化物是___,它与D的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式是____。
(6)欲证明E2的氧化性强于I2,可进行的实验操作是___,观察到的现象是___,有关反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃,分别向10 mL浓度均为1 mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度对数(lgc)的关系如图所示。
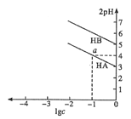
已知:pKa = -lgKa。
下列叙述正确的是
A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA) = 0.1 mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa≈5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用碘量法来测定样品中N2H4·H2O的含量。取样品5.000 g,加水配成250 mL无色溶液,已知溶液呈碱性,取25.00 mL溶液,用滴定管盛装0.2000 mol/L的I2标准液进行滴定。滴定反应中氧化产物和还原产物分别为N2和I-。
(1)用_____________填“酸式”或“碱式”)滴定管盛装I2标准液,在取液、盛装、滴定过程中还需要的玻璃仪器有_____________________________________。
(2)滴定过程中,需要加入_____作为指示剂,滴定终点的判断方法___________。
(3)滴定前后液面如图所示,所用I2标准液的体积为________________mL。

(4)样品中水合肼(N2H4·H2O)的质量分数为_____________________,若滴定过程中,盛放I2标准液的滴定管刚开始有气泡,滴定后无气泡,则测得样品中水合肼(N2H4·H2O)的质量分数____________填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
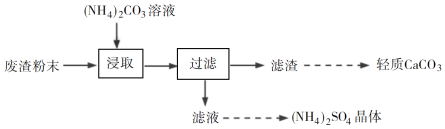
(1)室温下,反应CaSO4(s)+![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)达到平衡,则溶液中
(aq)达到平衡,则溶液中 =________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
=________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为________;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是________;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________。

(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:______[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com