
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
【答案】大于 C 小于 2.02 COOH![]() +H
+H![]() +H2O
+H2O![]() =COOH
=COOH![]() +2H
+2H![]() +OH
+OH![]() 或H2O
或H2O![]() =H
=H![]() +OH
+OH![]() 0.0047 b c a d
0.0047 b c a d
【解析】
(1)由H2、CO与CoO反应后其气体物质的量分数判断二者的倾向大小;
(2)根据三段式以及CO与H2的倾向大小关系综合判断;
(3)根据反应物与生成物的相对能量差大小进行比较判断;根据反应物达到活化状态所需能量为活化能以及相对能量差值大小计算并比较最大能垒;根据最大能垒对应的反应历程对应的物质写出方程式;
(4)根据图中曲线a在30~90 min内分压变化量计算平均反应速率;先根据CO与H2的倾向大小关系判断CO与H2的含量范围,然后根据温度变化对化学平衡的影响判断出在不同温度下曲线对应的物质。
(1)H2还原氧化钴的方程式为:H2(g)+CoO(s)![]() Co(s)+H2O(g);CO还原氧化钴的方程式为:CO(g)+CoO(s)
Co(s)+H2O(g);CO还原氧化钴的方程式为:CO(g)+CoO(s)![]() Co(s)+CO2(g),平衡时H2还原体系中H2的物质的量分数(
Co(s)+CO2(g),平衡时H2还原体系中H2的物质的量分数(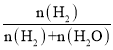 )高于CO还原体系中CO的物质的量分数(
)高于CO还原体系中CO的物质的量分数(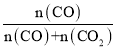 ),故还原CoO(s)为Co(s)的倾向是CO大于H2;
),故还原CoO(s)为Co(s)的倾向是CO大于H2;
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,可设其物质的量为1mol,则
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol) 1 1 0 0
转化(mol) x x x x
平衡(mol) 1-x 1-x x x
则平衡时体系中H2的物质的量分数=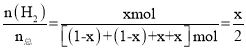 ,因该反应为可逆反应,故x<1,可假设二者的还原倾向相等,则x=0.5,由(1)可知CO的还原倾向大于H2,所以CO更易转化为H2,故x>0.5,由此可判断最终平衡时体系中H2的物质的量分数介于0.25~0.50,故答案为C;
,因该反应为可逆反应,故x<1,可假设二者的还原倾向相等,则x=0.5,由(1)可知CO的还原倾向大于H2,所以CO更易转化为H2,故x>0.5,由此可判断最终平衡时体系中H2的物质的量分数介于0.25~0.50,故答案为C;
(3)根据水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]并结合水煤气变换的反应历程相对能量可知,CO(g)+H2O(g)的能量(-0.32eV)高于CO2(g)+H2(g)的能量(-0.83eV),故水煤气变换的ΔH小于0;活化能即反应物状态达到活化状态所需能量,根据变换历程的相对能量可知,最大差值为:
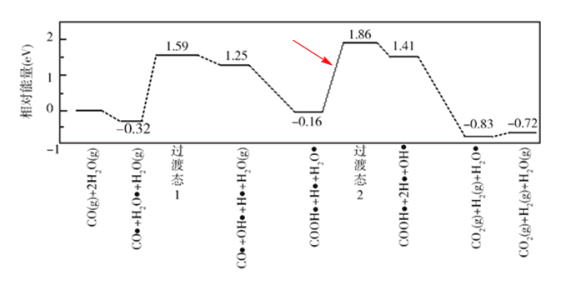
(4)由图可知,30~90 min内a曲线对应物质的分压变化量Δp=(4.08-3.80)kPa=0.28 kPa,故曲线a的反应在30~90 min内的平均速率![]() (a)=
(a)=![]() =0.0047 kPa·min1;由(2)中分析得出H2的物质的量分数介于0.25~0.5,CO的物质的量分数介于0~0.25,即H2的分压始终高于CO的分压,据此可将图分成两部分:
=0.0047 kPa·min1;由(2)中分析得出H2的物质的量分数介于0.25~0.5,CO的物质的量分数介于0~0.25,即H2的分压始终高于CO的分压,据此可将图分成两部分:
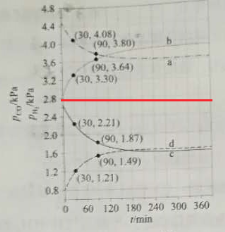
由此可知,a、b表示的是H2的分压,c、d表示的是CO的分压,该反应为放热反应,故升高温度,平衡逆向移动,CO分压增加,H2分压降低,故467 ℃时PH2和PCO随时间变化关系的曲线分别是b、c;489 ℃时PH2和PCO随时间变化关系的曲线分别是a、d。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子书写正确的是( )
A.碳酸氢钠溶液中加入盐酸:CO32﹣+2H+=CO2↑+H2O
B.向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体: Fe3++ 3H2O ![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.氢氧化铜与稀硫酸反应:H++OH﹣=H2O
D.澄清的石灰水与碳酸钠溶液反应:CO32﹣+Ca2+=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=—870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2=—393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3=—285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=__________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知N≡N键的键能是948.9kJ/mol,H—H键的键能是436.0 kJ/mol,N—H键的键能是391.55 kJ/mol,则N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=_________________。
2NH3(g) ΔH=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
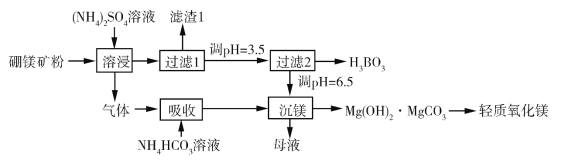
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径和主要化合价见下表,

下列有关说法中,正确的是
A. 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B. Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C. 最高价氧化物对应水化物的酸性L<Z
D. 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O三种元素,其质谱如图所示。将4.3 g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重8.8 g,则:

(1)该有机物的摩尔质量为____________g/mol。
(2)该有机物的分子式为 。
(3)1mol该有机物与足量的金属钠反应产生1mol氢气,核磁共振氢谱有两个峰,且面积比为2∶1,请写出其结构简式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com