
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.2.1gDTO中含有的质子数为NA
B.30g葡萄糖和冰醋酸的混合物中含有的氢原子数为4NA
C.12g石墨烯(单层石墨)中含有六元环的个数为2NA
D.1mol铁在一定条件下分别和氧气、氯气、硫完全反应转移电子数都为2NA
【答案】A
【解析】
A.DTO即水分子,不同于普通的H2O,该分子中的氢原子一个是氘(D)即![]() ,一个是氚(T)即
,一个是氚(T)即![]() ,但是本质仍旧是氢元素,所以一个DTO分子中质子数,即原子序数和为10,那么2.1gDTO的物质的量
,但是本质仍旧是氢元素,所以一个DTO分子中质子数,即原子序数和为10,那么2.1gDTO的物质的量![]() ,则0.1mol水中含有质子数为1NA,A正确;
,则0.1mol水中含有质子数为1NA,A正确;
B.葡萄糖的分子式为C6H12O6,冰醋酸的分子式为C2H4O2,两种物质的最简式均为CH2O,所以30g葡萄糖和醋酸的混合物,可看成30g的CH2O,其物质的量为![]() ,则其氢原子的个数为2NA,B项错误;
,则其氢原子的个数为2NA,B项错误;
C.石墨烯中碳原子形成正六边形的网格单元,每个碳原子都被三个六元环共用,平均算下来,一个六边形需要![]() 个碳原子,所以12g石墨烯中六边形的个数为0.5NA,C项错误;
个碳原子,所以12g石墨烯中六边形的个数为0.5NA,C项错误;
D.铁与氧气可以生成FeO或Fe3O4,1molFe被氧化电子转移数不一定;Fe与氯气反应生成FeCl3,所以1molFe被氯气氧化转移3mol电子;Fe与S反应生成FeS,所以1molFe被S氧化转移2mol电子,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某反应达到平衡,其平衡常数为![]() 。恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
。恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
A. 该反应的化学方程式为:NO2+CO = CO2+NOB. 该反应的焓变为负值
C. 升高温度,正反应速率减小D. 恒温时,增大压强,颜色加深,因平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
A.此反应无光照也可发生
B.甲烷和Cl2反应后的产物只有CH3Cl和HCl
C.CH4和Cl2完全反应后液面上升,液体充满试管
D.盛放饱和食盐水的水槽底部会有少量晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
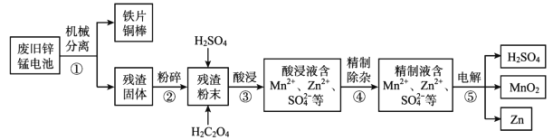
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
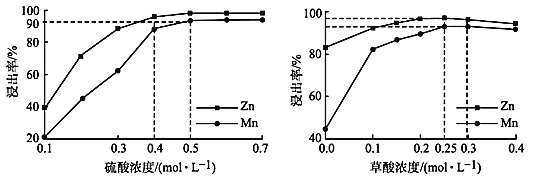
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】傅克反应是合成芳香族化合物的一种重要方法。有机物a(-R为烃基)和苯通过傳克反应合成b的过程如下(无机小分子产物略去)

下列说法错误的是
A. 一定条件下苯与氢气反应的产物之一环己烯与螺[2.3]己烷![]() 互为同分异构体
互为同分异构体
B. b的二氯代物超过三种
C. R为C5H11时,a的结构有3种
D. R为C4H9时,1molb加成生成C10H20至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学能与其他能量相互转化的说法正确的是( )
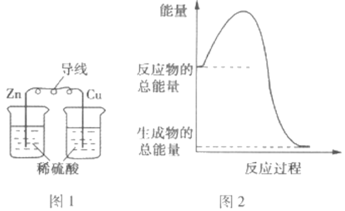
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为吸热反应
C.中和反应中,反应物的总能量比生成物的总能量低
D.化学反应中能量变化的根本原因是化学键的断裂与生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A. 500mL2mol·L-1 FeCl3溶液中Cl-数目为3NA,且n(Cl-)/n(Fe3+)=3
B. 电解法精炼铜,阴极析出1 mol Cu时,阳极失去的电子数为2NA
C. 64gSO2与足量的O2在一定条件下反应生成的SO3分子数目为NA
D. 在标准状况下,2.24LNH3通入水中制成氨水,溶液中NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:磷酸氯喹是治疗新型肺炎的潜力药。磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。回答下列问题

(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图

①该反应的化学方程式为___________(A用化学式表示)
②前10s的平均反应速率v(Cl2)=_______
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是___________(写名称)
②A与热水反应的化学方程式为____________。
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图______________,并作相应标注(标明正负极材料及电解质溶液的名称,电子移动方向、离子移动方向)。
(2)该装置中负极的电极方程式为________。
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com