
����Ŀ�������ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz�����������C�ĺϽ�����������ֽ�������A��B��C������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ(ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û�б��)��

�����������Ϣ�ش��������⣺
(1)����A��ԭ�ӽṹʾ��ͼ��_______________________________________��
(2)д���������ʵĻ�ѧʽ�� H��__________���ң�________________��
(3)C��һ���������Ǿ��д��Եĺ�ɫ���壬��������Ļ�ѧʽ��_____________��
(4)д����Ӧ�ٵ����ӷ���ʽ����Ӧ��______________________________��
(5)д����Ӧ�ڵĻ�ѧ����ʽ����Ӧ��___________________________________��
(6)������ҺE�������ӵij��÷�����____________________��
���𰸡�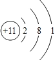 Fe(OH)3 Cl2 Fe3O4 Fe+2H+��Fe2++H2�� 2Al+2NaOH+2H2O��2NaAlO2+3H2�� �������ữ��AgNO3,���ְ�ɫ������֤����Cl-
Fe(OH)3 Cl2 Fe3O4 Fe+2H+��Fe2++H2�� 2Al+2NaOH+2H2O��2NaAlO2+3H2�� �������ữ��AgNO3,���ְ�ɫ������֤����Cl-
��������
�����ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ����ɫ��ӦΪ��ɫ��˵��������һ��������Ԫ�أ���AΪ����Na��Na��ˮ��Ӧ����NaOH�������������������D����Һ���������ƣ�����ɫ������������������Ϊ������������������Ӧ����HCl�����ΪHCl��E�����ᣬ���ɫ�ij���һ�����������������Խ���C������F���Ȼ�������G���Ȼ������ܺ��������Ʒ�Ӧ���������Ľ���ֻ����������B�ǽ�������
��1��AΪNaԭ������ԭ�ӵĺ�����������11����3�����Ӳ㣬����������Ϊ1�� ԭ�ӽṹʾ��ͼΪ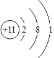 ���ʴ�Ϊ��
���ʴ�Ϊ��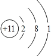 ��
��
��2���ɷ�����֪��HΪFe(OH)3����ΪCl2���ʴ�Ϊ��Fe(OH)3��Cl2��
��3���������������У����д��Եĺ�ɫ������Fe3O4���ʴ�Ϊ��Fe3O4��
��4����Ӧ��Ϊ����ϡ���ᷴӦ�����Ȼ���������������ѧ����ʽΪFe��2HCl��FeCl2��H2�������ӷ���ʽΪFe+2H+��Fe2++H2�����ʴ�Ϊ��Fe+2H+��Fe2++H2����
��5����Ӧ��Ϊ��������������Һ��Ӧ����ƫ�����ƺ���������ѧ����ʽΪ2Al��2NaOH��2H2O��2NaAlO2��3H2�����ʴ�Ϊ��2Al��2NaOH��2H2O��2NaAlO2��3H2����
��6����ҺE���Ȼ�����Һ����������ΪCl-������Cl-�ķ������������ữ��AgNO3�����ְ�ɫ������֤����Cl-���ʴ�Ϊ���������ữ��AgNO3�����ְ�ɫ������֤����Cl-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�Ͳ�Ʒ�к���H2S��COS��CH3SH�ȶ����л�����ʯ�ͻ�����������������������ش�����������
��1��COS�ĵ���ʽ��_______________��
��2����֪�Ȼ�ѧ����ʽ����2H2S(g)+SO2(g)=3S(s)+2H2O(l) ��H=-362kJ��mol-1
��2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ��H2=-1172kJ��mol-1
��H2S�����������Ӧ���ɹ�̬���Һ̬ˮ���Ȼ�ѧ����ʽΪ__________________��
��3��������K2CO3��Һ����H2S����ԭ��ΪK2CO3+H2S=KHS+KHCO3���÷�Ӧ��ƽ�ⳣ��Ϊ________��(��֪H2CO3��Ka1=4.2��10-7��Ka2=5.6��10-11��H2S��Ka1=5.6��10-8��Ka2=1.2��10-15)
��4����ǿ����Һ����H2O2�ɽ�COS����Ϊ��������һԭ��������COS�����÷�Ӧ��Ӧ�Ļ�ѧ����ʽΪ_________________��
��5��COS��ˮ�ⷴӦΪCOS(g)+H2O(g)![]() CO2(g)+H2S(g) ��H<0��ij�¶�ʱ���û�����-Al2O3���������ں����ܱ�������COS(g)��ƽ��ת�����治ͬͶ�ϱ�[n(H2O)/n(COS)]��ת����ϵ��ͼ1��ʾ������������ͬʱ���ı䷴Ӧ�¶ȣ����һ��ʱ����COS��ˮ��ת������ͼ2��ʾ��
CO2(g)+H2S(g) ��H<0��ij�¶�ʱ���û�����-Al2O3���������ں����ܱ�������COS(g)��ƽ��ת�����治ͬͶ�ϱ�[n(H2O)/n(COS)]��ת����ϵ��ͼ1��ʾ������������ͬʱ���ı䷴Ӧ�¶ȣ����һ��ʱ����COS��ˮ��ת������ͼ2��ʾ��

���÷�Ӧ���������Ϊ:Ͷ�ϱ�[n(H2O)/n(COS)]____���¶�_____________
��P���Ӧ��ƽ�ⳣ��Ϊ_____________��(����С�����2λ)
�����¶����ߵ�һ��ֵ��������һ��ʱ����COS(g)��ˮ��ת���ʽ��ͣ��²���ܵ�ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��һ����Ҫ�ķ�Ӧ��
��1����֪��ӦCu��2Fe3+=Cu2+��2Fe2+��������Fe3+_____Cu2+(� �� ���� �� ��) ��
��2����2Na2O2+2CO2��2Na2CO3+O2��Ӧ�У���ת��3mol���ӣ����������������ڱ�״���µ����Ϊ______��
��3����xR2++yH++O2�TmR3++nH2O�����ӷ���ʽ�У���ϵ��m��R2+��R3+�ж���ȷ����___________��
A��m=y��R3+�ǻ�ԭ�� B��m=2y��R2+������
C��m=2��R3+�������� D��m=4��R2+�ǻ�ԭ��
��4��ʵ�������������������������з�����ȡ�ģ�4HCl��Ũ����MnO2![]() Cl2����MnCl2��2H2O�����������뻹ԭ�������ʵ���֮��_____________��д���÷�Ӧ�����ӷ���ʽ__________________________
Cl2����MnCl2��2H2O�����������뻹ԭ�������ʵ���֮��_____________��д���÷�Ӧ�����ӷ���ʽ__________________________
��5��������ʹ����KMnO4��Һ��ɫ����ƽ����Ļ�ѧ����ʽ�� KMnO4+ H2SO4+ H2C2O4 = MnSO4+ K2SO4 + CO2���� H2O����Ϊ��________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д���������ǣ�������
A.Na+��H+��Cl����HCO3��
B.K+��Fe3+��NO3����SO42��
C.Ca2+��H+��C1����OH��
D.Na+��Ba2+��CO32����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ�ĵ⣬Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飺
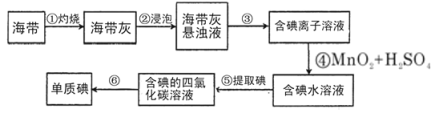
����д���пհף�
��1������۵�ʵ�����������________���ò����õ��IJ����������ձ���_________��________��
��2��������õ��IJ����������ձ����____________���ܷ����Ҵ�������CCl4________����ܡ�����
��3�������ʵ�����������________��
��4������۵õ�����Һ��c��I������0.04mol/L����ʹ��c��I������0.01mol/L����Һ480mL����ȡ�ø���Һ________mL�����в�����ʹ���Ƶ���Һ�����ʵ���Ũ��ƫС����_________��
A��ϡ����Һʱ��Һ�彦�� B������ƿ������������ˮ����
C��ȡ��Һʱ���ӿ̶��� D��������ƿ�м�ˮ����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() (a)��
(a)��![]() (b)�ķ���ʽ��ΪC8H8������˵����ȷ����
(b)�ķ���ʽ��ΪC8H8������˵����ȷ����
A. a��b��һ�ȴ���ֱ���5�ֺ�3��(�����������칹)
B. a��b������ԭ�Ӿ����ܴ���ͬһƽ��
C. a��b����ʹ������Ȼ�̼��Һ��ɫ
D. a��ͬ���칹��ֻ��bһ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ���� 1.0 L w mol��L��1 CH3COOH ��Һ�� 0.1 mol NaOH�����ϣ���ַ�Ӧ��Ȼ������Һ�м���CH3COOH��CH3COONa����(����������¶ȱ仯)����ҺpH�ı仯��ͼ������������ȷ����
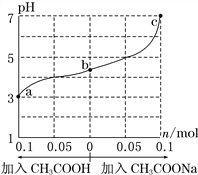
A. b����Һ��c(Na��)>c(CH3COO��)
B. ����CH3COOH������![]() ����
����
C. c����ڣ�c(CH3COOH)+c(CH3COO��) =0.1+w
D. a��b��c��Ӧ�Ļ��Һ�У�ˮ�ĵ���̶��ɴ�С��˳����c>a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����ϵĹ������ƺ�̼�����ƹ������ܱ������м��ȣ�ʹ���ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ���������
A. NaOH��Na2CO3 B. Na2O2��Na2CO3
C. Na2CO3 D. Na2O2��NaOH��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��������̫���ܵ�صIJ���
B.SO2���������ԣ�������Ư��ֽ��
C.AlCl3������ұ��������
D.ҽѧ�ϳ���̼�ᱵ��Ϊ�ڷ���Ӱ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com