
【题目】海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
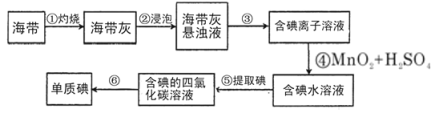
请填写下列空白:
(1)步骤③的实验操作名称是________,该操作用到的玻璃仪器有烧杯,_________,________。
(2)步骤⑤用到的玻璃仪器除烧杯外还有____________,能否用乙醇来代替CCl4________(填“能”或“否”)。
(3)步骤⑥的实验操作名称是________。
(4)步骤③得到的滤液中c(I-)=0.04mol/L,欲使用c(I-)=0.01mol/L的溶液480mL,需取用该滤液________mL。下列操作会使配制的溶液的物质的量浓度偏小的是_________。
A.稀释溶液时有液体溅出 B.容量瓶中有少量蒸馏水残留
C.取滤液时仰视刻度线 D.向容量瓶中加水定容时仰视刻度线
【答案】过滤 漏斗 玻璃棒 分液漏斗 否 蒸馏 125 AD
【解析】
(1)不溶于水的物质需要过滤分离,根据过滤操作来分析用到的实验仪器;
(2)步骤⑤为从碘水中萃取碘单质,需要萃取分液,用到分液漏斗;根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多分析;
(3)步骤⑥的目的是从含碘的四氯化碳溶液中分离出单质碘和回收四氯化碳,利用沸点的差异用蒸馏的方法;
(4)配制480mL溶液需要500mL容量瓶,结合c=n/V和实验操作分析可能产生的误差。
(1)步骤③是从海带灰的悬浊液中得到含碘离子的溶液,其实验操作名称是过滤,该操作用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)步骤⑤为从碘水中萃取碘单质,需要萃取分液,用到的玻璃仪器除烧杯外还有用到分液漏斗。由于乙醇和水互溶,所以不能用乙醇来代替CCl4;
(3)步骤⑥的目的是从含碘的四氯化碳溶液中分离出单质碘和回收四氯化碳,是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏;
(4)步骤③得到的滤液中c(I-)=0.04mol/L,欲使用c(I-)=0.01mol/L的溶液480mL,由于需要使用500mL容量瓶,因此需取用该滤液的体积为![]() =125mL。
=125mL。
A.稀释溶液时有液体溅出,溶质的物质的量减少,浓度偏小;
B.容量瓶中有少量蒸馏水残留不影响溶质的物质的量和溶液体积,浓度不变;
C.取滤液时仰视刻度线导致实际量取的体积增加,所以浓度偏大;
D.向容量瓶中加水定容时仰视刻度线,溶液体积增加,浓度偏小。
答案选AD。


科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
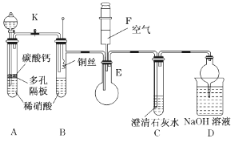
(1)设计装置A的目的是________________________________________,为达此目的应进行的操作____________________________________________________________________________;A中反应的化学方程式是_________________________________________________________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是_______;B中反应的离子方程式是_________________________________________________________。
(3)装置E和F的作用是__________________________________________________________,为实现此目的,操作方法是_______________________________________________________。
(4)D装置的作用是_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.下列叙述不正确的是( )
A. 氧化剂为KMnO4,其中Cl元素被还原
B. 若有0.5molCl2生成,则反应中有NA个电子转移
C. 浓HCl在反应中起酸性和还原性的作用
D. 若消耗0.4mol氧化剂,则被氧化的还原剂的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的物理性质的叙述中正确的是( ) ①银白色金属;
②质软,可以用小刀切割;
③熔点低于100℃;
④密度比水小;
⑤热和电的良导体.
A.①②④
B.①②③④
C.①③④
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。

请根据以上信息回答下列问题:
(1)画出A的原子结构示意图:_______________________________________,
(2)写出下列物质的化学式: H:__________、乙:________________,
(3)C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是_____________。
(4)写出反应①的离子方程式:反应①______________________________;
(5)写出反应②的化学方程式:反应②___________________________________;
(6)检验溶液E中阴离子的常用方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,测得0.01 mol/L的NaOH溶液的pH为11,在此温度下,将pH=12的强碱与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比为( )
A. 1∶9 B. 9∶1 C. 1∶11 D. 11∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是三种难溶金属硫化物的溶度积常数(25 ℃):下列有关说法中正确的是
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
A. 25 ℃时,将CuS固体用含Mn2+的饱和溶液浸泡可溶解CuS固体
B. 25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol·L-1
C. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
D. 因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种离子一定能大量共存的是
A. 强碱性溶液中:Na+、K+、AlO2-、CO32—
B. 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42—、CO32—
D. c(OH-)=1×10-13mol/L的溶液中:K+、Fe2+、Cl-、NO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com