
【题目】下列各种离子一定能大量共存的是
A. 强碱性溶液中:Na+、K+、AlO2-、CO32—
B. 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42—、CO32—
D. c(OH-)=1×10-13mol/L的溶液中:K+、Fe2+、Cl-、NO3—
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
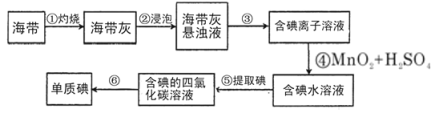
请填写下列空白:
(1)步骤③的实验操作名称是________,该操作用到的玻璃仪器有烧杯,_________,________。
(2)步骤⑤用到的玻璃仪器除烧杯外还有____________,能否用乙醇来代替CCl4________(填“能”或“否”)。
(3)步骤⑥的实验操作名称是________。
(4)步骤③得到的滤液中c(I-)=0.04mol/L,欲使用c(I-)=0.01mol/L的溶液480mL,需取用该滤液________mL。下列操作会使配制的溶液的物质的量浓度偏小的是_________。
A.稀释溶液时有液体溅出 B.容量瓶中有少量蒸馏水残留
C.取滤液时仰视刻度线 D.向容量瓶中加水定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:

请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。____________
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)操作中通空气和加热的先后顺序为_______________________________。
(5)加热装置Ⅰ时发生反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-1gc。常温下,某浓度的H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)的变化如图所示。下列说法正确( )
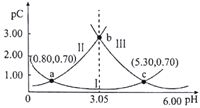
A. 曲线Ⅱ表示pC(HA-)随pH的变化
B. 当pH=1.40时,c(H2A)>c(A2-)>c(HA-)
C. 常温下,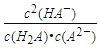 =104.50
=104.50
D. a、b、c三点对应的溶液中,c(H2A)+c(HA-)+c(A2-)的值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硅是制造太阳能电池的材料
B.SO2具有氧化性,可用于漂白纸浆
C.AlCl3可用作冶炼金属铝
D.医学上常用碳酸钡作为内服造影剂“钡餐”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
(1)在T1、T2温度下,一定量的NO(g)发生分解反应时,N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H_____0(填“>"或“<”)。
2NO(g)的△H_____0(填“>"或“<”)。
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=_________。该温度下,若增大压强此反应的平衡常数将_________(填“增大”、“减小”、“不变”或“无法确定”),若向上述容器中再充入2molN2(g)与1molO2(g),则再次达到平衡时O2的转化率________(填“增大”、“减小”、“不变”或“无法确定”)。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染,从而达到脱硝的目的:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJmol-1
甲烷直接被NO2还原为N2的热化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
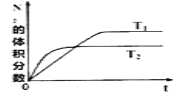
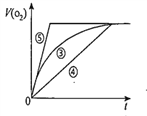
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在室温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol/LlFeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCI溶液 | 1mL0.1mol/LlFeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LlFeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进________________________。
(3)写出实验③的化学反应方程式___________________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析上图能够得出的实验结论是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com