
【题目】汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
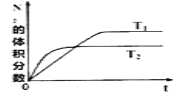
(1)在T1、T2温度下,一定量的NO(g)发生分解反应时,N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H_____0(填“>"或“<”)。
2NO(g)的△H_____0(填“>"或“<”)。
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=_________。该温度下,若增大压强此反应的平衡常数将_________(填“增大”、“减小”、“不变”或“无法确定”),若向上述容器中再充入2molN2(g)与1molO2(g),则再次达到平衡时O2的转化率________(填“增大”、“减小”、“不变”或“无法确定”)。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染,从而达到脱硝的目的:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJmol-1
甲烷直接被NO2还原为N2的热化学方程式为______________________________
【答案】 > 0.01mol/(L·s) 不变 不变 CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) H=-867 kJ·mol-1
【解析】(1)根据图像可知,T2温度可逆反应先达平衡,说明温度T2>T1;T1向T2转变,即升温过程中,N2的体积分数减小,说明平衡正向移动,即正向为吸热反应,△H>0;正确答案:>。
(2) 2L密闭容器 N2(g)+O2(g)![]() 2NO(g)
2NO(g)
起始量:10 5 0
变化量:1 1 2
平衡量:9 4 2
v(N2)=1÷2÷50=0.01mol/(L·s);平衡常数只是温度的函数,温度不变,平衡常数不变;
其他条件不变,按照原物质投料方式进行等比例增加投料,相当于给反应加压,由于该反应为反应前后体积变化为0的反应,加压,平衡不动,O2转化率不变;正确答案:0.01mol/(L·s); 不变; 不变。
(3)根据盖斯定律,把两个方程式直接相加和,整理,并计算相应的△H,得出甲烷直接被NO2还原为N2的热化学方程式;正确答案:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) H=-867 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】某温度时,测得0.01 mol/L的NaOH溶液的pH为11,在此温度下,将pH=12的强碱与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比为( )
A. 1∶9 B. 9∶1 C. 1∶11 D. 11∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
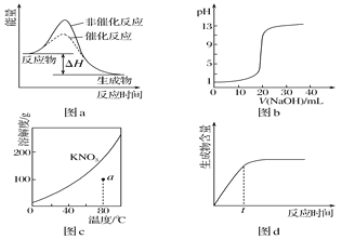
A. 图a表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图b表示0.100 0mol·L-1NaOH溶液滴定20.00mL 0.100 0mol·L-1CH3COOH溶液所得到的滴定曲线
C. 图c表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D. 图d表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时刻反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种离子一定能大量共存的是
A. 强碱性溶液中:Na+、K+、AlO2-、CO32—
B. 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42—、CO32—
D. c(OH-)=1×10-13mol/L的溶液中:K+、Fe2+、Cl-、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )
①升高温度;②增大压强;③增大反应物的物质的量;④将块状固体反应物磨成粉末
A.①②③④B.①④C.①③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 乙烯和丙烯组成的42g混合气体中碳氢键数目为6NA
B. 标准状兄下,22.4L二氯甲烷的分子数约为NA
C. 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为12NA
D. 将1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年进入冬季,我国许多城市就会出现雾霾天气。下列做法能减轻雾霾形成的是( )
A. 市郊露天焚烧秸秆 B. 推广使用燃煤发电
C. 大量使用机动车辆 D. 多利用太阳能发电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com