
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
|
实验编号 |
T/K |
c(Na2S2O3)/ mol·L-1 |
c(H2SO4)/ mol·L-1 |
实验目的 |
|
① |
298 |
0.1 |
0.1 |
实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
|
② |
308 |
|
|
|
|
③ |
|
0.2 |
|
|
|
④ |
|
0.1 |
|
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________ (提示:S元素被氧化为SO)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂: 1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量固体于试管中,加蒸馏水溶解 |
|
|
步骤2:
|
|
|
步骤3:
|
|
(16分)
(1) 表格内每空1分,共6分
|
实验编号 |
T/K |
c(Na2S2O3)/mol·L-1 |
c(H2SO4)/mol·L-1 |
|
① |
|
|
|
|
② |
|
0.1 |
0.1 |
|
③ |
298 |
|
0.1 |
|
④ |
298 |
|
0.2(不填0.1的均给分) |
(2)Na2S2O3+4Cl2+5H2O =Na2SO4+8HCl+H2SO4(2分,未配平给1分)
(或Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4)
(3)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量固体于试管中,加蒸馏水溶解 |
|
|
步骤2:向试管中加入过量1 mol·L-1 HCl溶液,充分振荡,静置(2分) |
有淡黄色沉淀生成(2分) |
|
步骤3:取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液(2分) |
有白色沉淀生成,证明固体中混有Na2SO4(2分) [或无白色沉淀生成,证明固体中无Na2SO4] |
步骤2:步骤与现象、结论不株连。未写“过量”扣1分;缺少“充分振荡”扣一分。现象和结论中:刺激性气味气体或气泡产生可给分。
步骤3:无“少量”不扣分,将BaCl2写成Ba(NO3)2的不得分,不株连现象和结论
【解析】
试题分析:(1)设计对比实验时,必须其他变量保持不变,只有一个变量;依题意可知,①与②的目的是探究温度对化学反应速率的影响规律,因此两种反应物的起始浓度应保持不变,都是0.1mol/L;①与③的目的是探究反应物浓度对化学反应速率的影响规律,则温度都是298K、硫酸的初始浓度都是0.1mol/L;①与④的目的是探究反应物浓度对化学反应速率的影响规律,则温度都是298K、硫代硫酸钠的初始浓度都是0.1mol/L,硫酸的初始浓度变为0.2mol/L或其它合理的答案;(2)书写陌生的氧化还原反应时,先确定氧化剂、还原剂、氧化产物和还原产物,再确定化合价升降数目,然后根据最小公倍数法确定氧化剂和还原剂的系数,最后用观察法配平其它物质的系数;综上所述,该反应为Na2S2O3+4Cl2+5H2O === Na2SO4+8HCl+H2SO4或Na2S2O3+4Cl2+5H2O === 2NaCl+6HCl+2H2SO4;(3)硫酸钠常用硫酸根离子的沉淀法检验,但是Na2S2O3也能与氯化钡溶液产生白色沉淀,干扰硫酸钠的检验,所以需要先除去样品中的Na2S2O3;由于Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成,加硫酸会引入硫酸根离子,硝酸能将硫代硫酸根离子氧化为硫酸根离子,干扰硫酸根离子的检验,因此步骤2中只能加入过量1 mol·L-1 HCl溶液,充分振荡,静置,有淡黄色沉淀生成或产生有刺激性气味的气体,说明Na2S2O3已经被转化为NaCl、单质硫和SO2;除去硫代硫酸根离子之后,取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液,振荡,有白色沉淀生成,证明固体中混有Na2SO4[或无白色沉淀生成,证明固体中无Na2SO4]。
考点:考查探究实验,涉及设计实验方案探究外界条件对化学反应速率的影响、氧化还原反应方程式的书写和配平、设计实验方案检验硫酸钠的存在、设计实验方案除去硫酸钠中的硫代硫酸钠等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2014届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:实验题
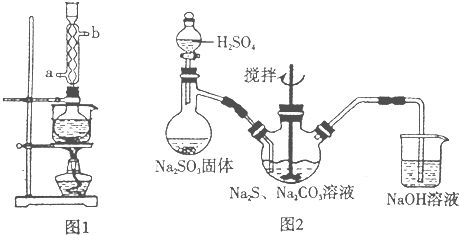
硫代硫酸钠( Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氧剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
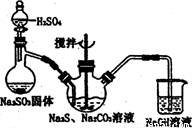
图l 图2
(1)用图l所示装置制取Na2S2O3,其中NaOH溶液的作用是: 。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。
为测定所得保硷粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2 Na2S2O3+I2=2NaI+Na2S4O6。
(2)利用KIO3、KI和HCI可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
(3)准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示荆,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
(4)若漓定时振荡不充分,刚看到溶液局部变色就停止漓定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果____(填“偏高”偏低”或“不变”)。
(5)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。
已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通人冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下‘
④ ;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com