
【题目】汽车用汽油的抗爆剂约含17%的1,2—二溴乙烷(无色液体,沸点:131℃,熔点:9.3℃)。同学们在实验室拟制备少量1,2—二溴乙烷,流程如图:
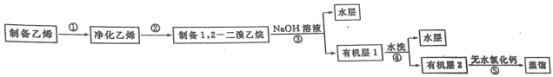
任务I:1,2—二溴乙烷的制备(利用如图装置,完成流程图中步骤①和②)
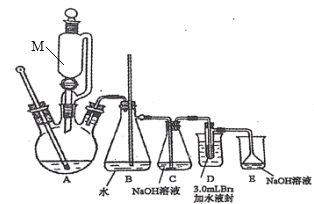
(i)在冰水冷却下,将24 mL浓硫酸注入12 mL乙醇中混合均匀。
(ii)向D装置的试管中加入3.0 mL液溴(0.10 mol),加入适量水液封,并向烧杯中加入冷却剂。
(ⅲ)连接仪器并检查装置的气密性。向三颈烧瓶中加入碎瓷片,通过M向三颈烧瓶中加入部分硫酸与乙醇的混合物,一部分留在M中。
(iv)先切断C、D的连接处,加热三颈烧瓶,待温度上升到120℃,连接C、D,待温度升到180℃~200℃,通过M慢慢滴入混合液。
(v)继续加热三颈烧瓶,待D中试管内的颜色完全褪去,切断C、D的连接,停止加热。
回答问题:
(1)图中仪器M的名称是_______。
(2)图中B装置中玻璃管的作用是_________。
(3)步骤ⅳ中“先切断C、D的连接处,再加热三颈烧瓶”的原因是______。
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为_______。
A. 冰水混合物 B. 5℃的水 C. 10℃的水
任务Ⅱ:1,2—二溴乙烷的纯化(流程图中步骤③④⑤)
步骤③冷却后,把装置D试管内的产物转移至分液漏斗,用1%的NaOH水溶液洗涤。
步骤④:用水洗涤至中性。
步骤⑤:向所得的有机层中加适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130℃~132℃的馏分,得到产品4.70 g。
(5)步骤③中加入1%的NaOH水溶液时,发生反应的化学方程式为________。
(6)步骤⑤中加入无水氯化钙的作用为_____。该实验所得产品的产率为_______。
【答案】恒压漏斗 安全瓶,指示B中压强变化,避免气流过快仪器压强过大 减少气体对溴水搅动,减少溴蒸气的挥发 C Br2+2OH-=Br-+BrO-+H2O 干燥产品(除去产品中的水) 25%
【解析】
结合装置图知,A 装置是浓硫酸与乙醇混合加热用于乙烯的制备,B是安全瓶,防止倒吸,C进行乙烯的净化,除去杂质CO2、SO2,D装置进行 1,2 -二溴乙烷的制备,E进行尾气吸收。B中玻璃管的作用是指示B中的压强变化,避免气流过快引起B中压强过大,在 1,2 一二溴乙烷的净化阶段,第一步加入NaOH溶液是为了吸收剩余的Br2,第二步水洗是为了洗去NaOH溶液,第三步的无水氯化钙用来干燥生成的 1,2 一二溴乙烷,据此分析解答。
(1)根据图示可知图中仪器M的名称是恒压漏斗;
(2)不论是C装置中NaOH溶液吸收CO2和SO2等酸性杂质气体,倒吸到装置B中,还是装置A中一旦堵塞,装置B中内的液体进入到长玻璃管内,所以装置B的作用是用作安全瓶的作用,可指示B中压强变化,避免气流过快引起压强过大;
(3)加热三口瓶前,先切断瓶C和瓶D的连接处,气体就不能进入到装有溴的装置内,减少气体对溴水搅动,减少溴蒸气的挥发;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,故开始反应时为防止液溴挥发,要给装置D的烧杯中降温,又已知:1,2-二溴乙烷的沸点为 131℃,熔点为 9.3℃,在 D 中制备时防止产品堵塞试管,要确保 1,2 一二溴乙烷呈液态,故最好用10℃的冷水,故合理选项是C;
(5)由于溴有挥发性、有毒,根据Br2能够与碱反应产生可溶性物质的性质,用1%的NaOH水溶液吸收多余的Br2,Br2与NaOH反应产生NaBr、NaBrO和H2O,发生反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O;
(6)分液后,加干燥剂除去产品中的水分,加入无水氯化钙目的是干燥生成的 1,2-二溴乙烷;根据反应方程式为:Br2+CH2=CH2→CH2Br-CH2Br,通入0.10 mol Br2,则理论上产生0.10 mol CH2Br-CH2Br,则1,2 -二溴乙烷理论产量是m(CH2Br-CH2Br)=n·M=0.10 mol×188 g/mol=18.8 g,实际产量是4.70 g,因此1,2-二溴乙烷的产率是![]() ×100%=25%。
×100%=25%。


科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
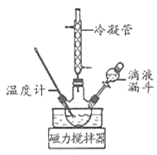
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
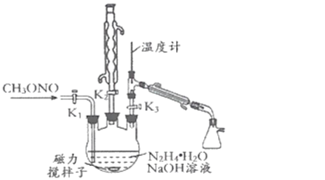
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物,在标准状况下,其蒸气密度为2.054g/L,则其摩尔质量为_____________,又知4.6克该有机物完全燃烧生成二氧化碳2.24L(标准状况)和1.8克水,则该有机物的分子式为________,该有机物能与乙醇发生酯化反应,则该有机物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
B | 向某钠盐X溶液中加入盐酸,将产生的气体通入 | 有白色沉淀产生 | 反应生成的气体可能为 |
C | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子的浓度均减小 |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧 | 直接观察,火焰呈黄色 | 溶液中的金属阳离子只有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的说法,正确的是( )
A.分子式为C5H12的有机物有三种,它们互为同系物
B.C4H8Cl2有9种同分异构体(不考虑立体异构)
C.石蜡油、苯、四氟乙烯都不能使溴水因反应而褪色
D.等物质的量的甲烷与氯气反应后体积保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com