
【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
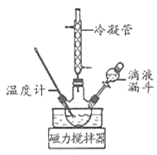
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
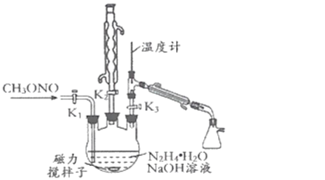
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL
【答案】防止过量的NaClO溶液将水合肼氧化 ![]() CO(NH2)2+ClO-+2OH-
CO(NH2)2+ClO-+2OH-![]() N2H4·H2O+Cl-+CO32- 20℃水浴 关闭K1、K2,打开K3 CH3ONO+N2H4·H2O+NaOH=NaN3+CH3OH+3H2O 蒸发浓缩、冷却结晶 真空或隔绝空气 100
N2H4·H2O+Cl-+CO32- 20℃水浴 关闭K1、K2,打开K3 CH3ONO+N2H4·H2O+NaOH=NaN3+CH3OH+3H2O 蒸发浓缩、冷却结晶 真空或隔绝空气 100
【解析】
(1) NaClO在碱性条件下把CO(NH2)2氧化为N2H4H2O,根据电子守恒配平离子方程式;
(2)①水浴加热便于控制温度;右侧为蒸馏装置;②亚硝酸甲酯与水合肼在碱性条件下反应生成叠氮化钠、甲醇和水;
(3) 叠氮化钠溶液蒸发浓缩、冷却结晶可获得叠氮化钠晶体;
(4)叠氮化钠常使用次氯酸钠溶液处理,根据氮元素化合价高,氯元素化合价降低,二者反应可生成无毒的气体N2,则氯只能从+1降到-1价,根据电子守恒,反应方程式是2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH;
(1)在碱性条件下NaClO把CO(NH2)2氧化为N2H4H2O,由于水合肼具有强还原性,为防止过量的NaClO溶液将水合肼氧化,实验中要缓慢滴加NaClO溶液;N2H4 的结构式为![]() ,根据得失电子守恒,该反应的离子方程式是CO(NH2)2+ClO-+2OH-
,根据得失电子守恒,该反应的离子方程式是CO(NH2)2+ClO-+2OH-![]() N2H4·H2O+Cl-+CO32-;
N2H4·H2O+Cl-+CO32-;
(2)①水浴加热便于控制温度,温度在20℃左右反应的转化率最高,所以采用20℃水浴加热;右侧为蒸馏装置,溶液蒸馏前,关闭K1、K2,打开K3;
②亚硝酸甲酯与水合肼在碱性条件下反应生成叠氮化钠、甲醇和水,反应方程式是CH3ONO+N2H4·H2O+NaOH=NaN3+CH3OH+3H2O;
(3) 叠氮化钠溶液获得叠氮化钠晶体实验步骤为蒸发浓缩、冷却结晶,减压过滤,晶体用乙醇洗涤23次后,再在真空或隔绝空气干燥;
(4)设需要0.5mol L的NaClO溶液VmL;
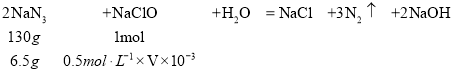
V=100;


科目:高中化学 来源: 题型:
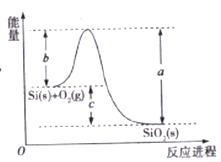
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.010mol/L的NaOH溶液滴定10.00mL 0.010mol/L的酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中lg![]() 的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
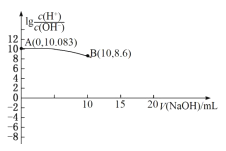
A.H2A![]() H++HA-
H++HA-
B.Ka(HA-)的数量级为10-5
C.滴定过程中,水的电离程度最大的为B点溶液
D.V(NaOH)=15mL时的溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应xM (g)+yN(g)![]() zP(g)。平衡时测得M的浓度为0.80 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0.50 mol/L。下列有关判断正确的是
zP(g)。平衡时测得M的浓度为0.80 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0.50 mol/L。下列有关判断正确的是
A.x + y < zB.平衡向正反应方向移动
C.N的转化率降低D.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M是合成医药的中间体,结构简式如图所示,下列说法不正确的是( )
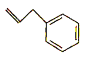
A.1molM完全燃烧需要消耗氧气11.5mol
B.M的所有碳原子可能共平面
C.M与H2完全加成产物的一溴代物有6种
D.M能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照《能源发展“十三五”规划》的要求,到2020年,中国煤炭消费总量控制在41亿吨以内,所占比重应减少到58%。推进煤炭清洁高效利用是我国能源发展重要举措之一。![]() 在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述不正确的是( )
在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述不正确的是( )
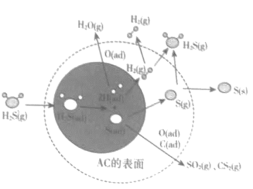
A.图中阴影部分为![]() 的解离过程
的解离过程
B.图中既有O-H键的形成也有O-H键的断裂
C.![]() 在AC表面的去除率与温度有关
在AC表面的去除率与温度有关
D.![]() 在AC表面作用生成的产物有
在AC表面作用生成的产物有![]() 等
等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的四种短周期主族元素,常见单质分子
是原子序数依次增大的四种短周期主族元素,常见单质分子![]() 中含有3对共用电子对,由
中含有3对共用电子对,由![]() 、
、![]() 形成的一种气态化合物不能稳定地存在于空气中,
形成的一种气态化合物不能稳定地存在于空气中,![]() 、
、![]() 同周期且
同周期且![]() 的最高正价是
的最高正价是![]() 的7倍。下列说法正确的是( )。
的7倍。下列说法正确的是( )。
A.含氧酸的酸性:![]()
B.简单离子半径:![]()
C.最简单氢化物的沸点:![]()
D.![]() 与
与![]() 形成的化合物中只含有离子键
形成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车用汽油的抗爆剂约含17%的1,2—二溴乙烷(无色液体,沸点:131℃,熔点:9.3℃)。同学们在实验室拟制备少量1,2—二溴乙烷,流程如图:
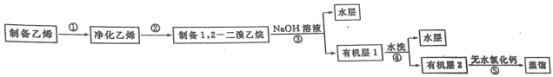
任务I:1,2—二溴乙烷的制备(利用如图装置,完成流程图中步骤①和②)
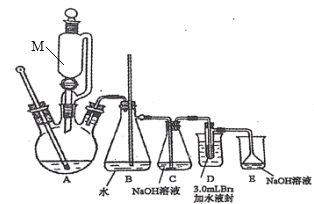
(i)在冰水冷却下,将24 mL浓硫酸注入12 mL乙醇中混合均匀。
(ii)向D装置的试管中加入3.0 mL液溴(0.10 mol),加入适量水液封,并向烧杯中加入冷却剂。
(ⅲ)连接仪器并检查装置的气密性。向三颈烧瓶中加入碎瓷片,通过M向三颈烧瓶中加入部分硫酸与乙醇的混合物,一部分留在M中。
(iv)先切断C、D的连接处,加热三颈烧瓶,待温度上升到120℃,连接C、D,待温度升到180℃~200℃,通过M慢慢滴入混合液。
(v)继续加热三颈烧瓶,待D中试管内的颜色完全褪去,切断C、D的连接,停止加热。
回答问题:
(1)图中仪器M的名称是_______。
(2)图中B装置中玻璃管的作用是_________。
(3)步骤ⅳ中“先切断C、D的连接处,再加热三颈烧瓶”的原因是______。
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为_______。
A. 冰水混合物 B. 5℃的水 C. 10℃的水
任务Ⅱ:1,2—二溴乙烷的纯化(流程图中步骤③④⑤)
步骤③冷却后,把装置D试管内的产物转移至分液漏斗,用1%的NaOH水溶液洗涤。
步骤④:用水洗涤至中性。
步骤⑤:向所得的有机层中加适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130℃~132℃的馏分,得到产品4.70 g。
(5)步骤③中加入1%的NaOH水溶液时,发生反应的化学方程式为________。
(6)步骤⑤中加入无水氯化钙的作用为_____。该实验所得产品的产率为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com