
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的四种短周期主族元素,常见单质分子
是原子序数依次增大的四种短周期主族元素,常见单质分子![]() 中含有3对共用电子对,由
中含有3对共用电子对,由![]() 、
、![]() 形成的一种气态化合物不能稳定地存在于空气中,
形成的一种气态化合物不能稳定地存在于空气中,![]() 、
、![]() 同周期且
同周期且![]() 的最高正价是
的最高正价是![]() 的7倍。下列说法正确的是( )。
的7倍。下列说法正确的是( )。
A.含氧酸的酸性:![]()
B.简单离子半径:![]()
C.最简单氢化物的沸点:![]()
D.![]() 与
与![]() 形成的化合物中只含有离子键
形成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车用汽油的抗爆剂约含17%的1,2—二溴乙烷(无色液体,沸点:131℃,熔点:9.3℃)。同学们在实验室拟制备少量1,2—二溴乙烷,流程如图:
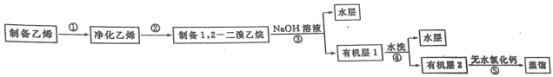
任务I:1,2—二溴乙烷的制备(利用如图装置,完成流程图中步骤①和②)
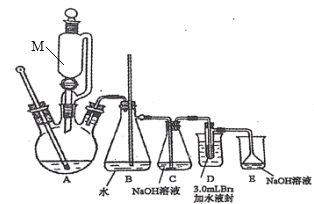
(i)在冰水冷却下,将24 mL浓硫酸注入12 mL乙醇中混合均匀。
(ii)向D装置的试管中加入3.0 mL液溴(0.10 mol),加入适量水液封,并向烧杯中加入冷却剂。
(ⅲ)连接仪器并检查装置的气密性。向三颈烧瓶中加入碎瓷片,通过M向三颈烧瓶中加入部分硫酸与乙醇的混合物,一部分留在M中。
(iv)先切断C、D的连接处,加热三颈烧瓶,待温度上升到120℃,连接C、D,待温度升到180℃~200℃,通过M慢慢滴入混合液。
(v)继续加热三颈烧瓶,待D中试管内的颜色完全褪去,切断C、D的连接,停止加热。
回答问题:
(1)图中仪器M的名称是_______。
(2)图中B装置中玻璃管的作用是_________。
(3)步骤ⅳ中“先切断C、D的连接处,再加热三颈烧瓶”的原因是______。
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为_______。
A. 冰水混合物 B. 5℃的水 C. 10℃的水
任务Ⅱ:1,2—二溴乙烷的纯化(流程图中步骤③④⑤)
步骤③冷却后,把装置D试管内的产物转移至分液漏斗,用1%的NaOH水溶液洗涤。
步骤④:用水洗涤至中性。
步骤⑤:向所得的有机层中加适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130℃~132℃的馏分,得到产品4.70 g。
(5)步骤③中加入1%的NaOH水溶液时,发生反应的化学方程式为________。
(6)步骤⑤中加入无水氯化钙的作用为_____。该实验所得产品的产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃水的电离常数是1.0×1014
B. 中性溶液的c(H+)=![]()
C. 纯水在100℃时,c(H+)>107mol·L1,所以此时纯水中c(H+)>c(OH)
D. pH<7的溶液一定是酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
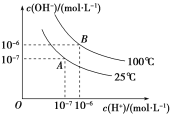
(1)A点水的离子积常数为1×1014,B点水的离子积常数为________________。造成水的离子积常数变化的原因是________________________________________________________________________。
(2)100 ℃时,若向水中滴加盐酸,________(填“能”或“不能”)使体系处于B点状态,原因是____________________________________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×104 mol·L1,则由水电离产生的c(H+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuS、Cu2S用于处理酸性废水中的Cr2O72-反应如下。反应I:CuS+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平) 反应Ⅱ:Cu2S+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平) 下列有关说法正确的是
A. 反应I和Ⅱ中各有2种元素的化合价发生变化
B. 处理1molCr2O72-时反应I、Ⅱ中消耗H+的物质的量相等
C. 反应Ⅱ中还原剂与氧化剂的物质的量之比为3:5
D. 质量相同时,Cu2S能去除更多的Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品。电化学法合成碳酸二甲酯的工作原理如图所示。下列说法错误的是
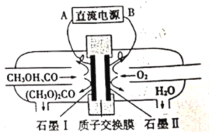
A.石墨I与直流电源正极相连
B.H+由石墨II通过质子交换膜向石墨I移动
C.石墨I上发生的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+
D.电解过程中,阴极和阳极消耗气体的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对硝基苯甲酸(![]() )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(![]() )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
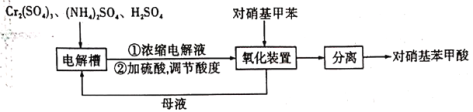
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__(填“A”或“B”),反应II的离子方程式为_______。
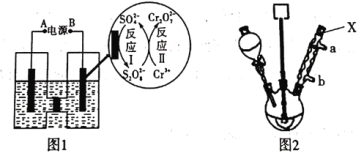
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____,冷却水应从___口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____法完成。
⑤该合成技术的优点是实现了____(填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____。
第一次 | 第二次 | 第三次 | 第四次 | |
体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 均为短周期主族元素,三种元素位于同一周期,
均为短周期主族元素,三种元素位于同一周期,![]() 两元素的最外层电子数之和与Z的最外层电子数相等,Y的最外层电子数是内层电子数的3倍。下列说法正确的是( )
两元素的最外层电子数之和与Z的最外层电子数相等,Y的最外层电子数是内层电子数的3倍。下列说法正确的是( )
A.原子半径:![]() B.最简单氢化物的热稳定性:
B.最简单氢化物的热稳定性:![]()
C.XZ为共价化合物D.![]() 的单质均不能与水发生反应
的单质均不能与水发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com