
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
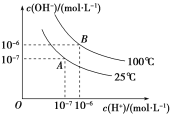
(1)A点水的离子积常数为1×1014,B点水的离子积常数为________________。造成水的离子积常数变化的原因是________________________________________________________________________。
(2)100 ℃时,若向水中滴加盐酸,________(填“能”或“不能”)使体系处于B点状态,原因是____________________________________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×104 mol·L1,则由水电离产生的c(H+)=__________。
【答案】1×1012 水的电离是吸热过程,温度升高,水的电离程度增大,则离子积常数增大 不能 滴加盐酸后,水的电离平衡左移,体系中c(H+)≠c(OH),故体系不可能处于B点状态 2×109 mol·L1
【解析】
(1)![]() ;水的离子积常数只与温度有关;
;水的离子积常数只与温度有关;
(2)水的离子积常数只与温度有关,温度不变,水的离子积常数不变;100 ℃时,若向水中滴加盐酸,c(H+)增大、c(OH)减小;
(3)100 ℃时,盐酸中水的电离受到抑制。
(1)B点Kw=106×106=1×1012,水的电离是吸热过程,温度升高,水的电离程度增大,则离子积常数增大;
(2)向水中加入盐酸,体系中c(H+)增大,水的电离平衡向左移动,c(OH)减小,c(H+)≠c(OH),体系不会处于B点状态;
(3)盐酸中水的电离受到抑制,100 ℃时,Kw=1×1012,若盐酸中c(H+)=5×104 mol·L1,则由水电离产生的c(H+)与溶液中的OH-的浓度相同,为1×1012÷(5×104)=2×109 mol·L1。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的叙述中,正确的是( )
A.NaHCO3俗名纯碱,Na2CO3俗名苏打
B.受热时,NaHCO3比Na2CO3容易分解
C.NaHCO3溶液显酸性,Na2CO3溶液显碱性
D.NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H=-akJ·mol-1
2CO2(g)+N2(g) H=-akJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=____________,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将__________(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为__________(结果保留两位有效数字)
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为_____________
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶体积的关系如图所示,由此确定,原溶液中含有的阳离子是:( )

A.Mg2+、Al3+、Fe2+B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:

已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4)![]() 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。

A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com