
【题目】机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H=-akJ·mol-1
2CO2(g)+N2(g) H=-akJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=____________,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将__________(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为__________(结果保留两位有效数字)
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为_____________
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol 0.01mol/(L·min) 40% a 逆向 0.28 2NO2+8e-+4CO2=N2+4CO32- ![]()
【解析】
(1)根据盖斯定律进行计算;
(2)据图可知0~20min内△c(NO)=0.2mol/L,据v(NO)=![]() 进行计算;CO的转化率=
进行计算;CO的转化率=![]() 进行计算;
进行计算;
(3)反应达到平衡后,正逆反应速率相等,各组分的浓度保持不变及由此衍生的其他物理量进行分析判断;
(4)根据平衡常数的计算公式进行计算;根据浓度商与平衡常数的关系判断反应进行的方向;平衡常数只是温度的函数,据此进行分析;
(5)原电池中正极得电子发生还原反应,该电池放电时NO2被还原成N2作正极,用熔融NaCO3作电解质,根据元素守恒和电荷守恒可得电极方程式;
(6)NH3·H2O的电离常数为Kb=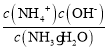 =1.7×10-5,pH=a,则可求出c(OH-),据此可以计算出
=1.7×10-5,pH=a,则可求出c(OH-),据此可以计算出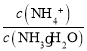 。
。
(1)已知:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
(2)据图可知0~20min内△c(NO)=0.2mol/L,所以v(NO)=![]() =0.01mol/(L·min),同一反应同一同时不同物质的反应速率之比等于计量数之比,所以v(CO2)=v(NO)=0.01mol/(L·min);△c(NO)=0.2mol/L,则△c(CO)=0.2mol/L,容器体积为2L,所以CO的转化率为
=0.01mol/(L·min),同一反应同一同时不同物质的反应速率之比等于计量数之比,所以v(CO2)=v(NO)=0.01mol/(L·min);△c(NO)=0.2mol/L,则△c(CO)=0.2mol/L,容器体积为2L,所以CO的转化率为![]() =40%;
=40%;
(3)a.该反应前后气体系数之和不相等,所以未达到平衡时容器内气体总物质的量会变,容器恒容,则压强会变,所以压强不再改变说明反应达到平衡,故a正确;
b.反应是否达到平衡并不影响反应的焓变,故b不能说明;
c.反应达到平衡时正反应速率等于逆反应速率,但选项中没有指明各物质的速率是正反应速率还是逆反应速率,故c不能说明;
d.反应物和生成物均为气体,所以整个过程中气体的总质量不变,容积恒定,则密度一直不变,故d不能说明;
综上所述选a;
(4)初始投料为1.2 mol NO、1.0 mol CO,容器体积为2L,则c(NO)=0.6mol/L,c(CO)=0.5mol/L;据图可知平衡时c(NO)=0.6mol/L,△c(NO)=0.2mol/L,根据方程式可知△c(CO)=0.2mol/L,△c(CO2)=0.2mol/L,△c(N2)=0.1mol/L,所以平衡时各物质的浓度为c(NO)=0.4mol/L,c(CO)=0.3mol/L,c(CO2)=0.2mol/L,c(N2)=0.1mol/L,则该温度下平衡常数为K=![]() ,充CO、CO2各0.2mol后,容器体积为2L,所以c(CO)=0.4mol/L,c(CO2)=0.3mol/L,此时浓度商为
,充CO、CO2各0.2mol后,容器体积为2L,所以c(CO)=0.4mol/L,c(CO2)=0.3mol/L,此时浓度商为![]() ,所以平衡逆向移动;温度不变平衡常数不变,平衡常数为0.28;
,所以平衡逆向移动;温度不变平衡常数不变,平衡常数为0.28;
(5)原电池中正极得电子发生还原反应,根据总反应中各物质的化合价的变化可知,该电池放电时NO2被还原成N2作正极,用熔融NaCO3作电解质,根据元素守恒和电荷守恒可得电极方程式为2NO2+8e-+4CO2=N2+4CO32-;
(6)NH3·H2O的电离常数为Kb=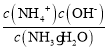 =1.7×10-5,pH=a,则c(OH-)=10a-14mol/L,所以
=1.7×10-5,pH=a,则c(OH-)=10a-14mol/L,所以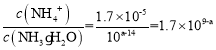 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶夜300ml,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A,B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B![]() aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
A.此时,反应混合物总物质的量为1molB.B的转化率40%
C.A的平均反应速率为0.1mol/(L·min)D.a值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=___kJ·mol-1。
SO3(g)+NO(g)的ΔH=___kJ·mol-1。
(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将___(填“增大”“减小”或“不变”)
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
A.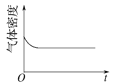 B.
B.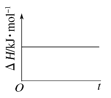 C.
C.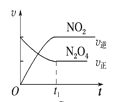 D.
D.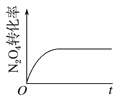
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,纯水中存在的平衡:H2O ![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
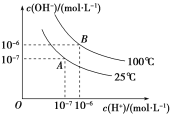
(1)A点水的离子积常数为1×1014,B点水的离子积常数为________________。造成水的离子积常数变化的原因是________________________________________________________________________。
(2)100 ℃时,若向水中滴加盐酸,________(填“能”或“不能”)使体系处于B点状态,原因是____________________________________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×104 mol·L1,则由水电离产生的c(H+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是
A. 混合气体中V(N2O4) = 0.336 L
B. 混合气体中n(NO)∶n(NO2) = 1∶5
C. NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5
D. 如采用氨的催化氧化法处理,理论消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是___(填字母)。
A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为__。砷酸的酸性弱于硒酸,从分子结构的角度解释原因____。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为__,画出配离子的结构式__(不考虑立体构型)。
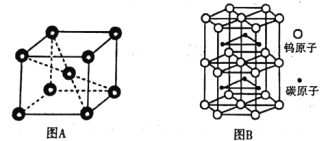
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为___。
②铬的晶胞结构如图A所示,它的堆积模型为____,在该晶胞中铬原子的配位数为_____。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为___,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是___g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
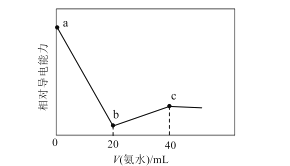
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com