
【题目】某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是___(填字母)。
A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为__。砷酸的酸性弱于硒酸,从分子结构的角度解释原因____。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为__,画出配离子的结构式__(不考虑立体构型)。
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为___。
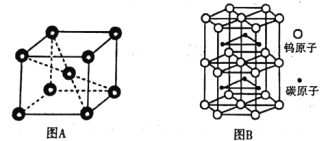
②铬的晶胞结构如图A所示,它的堆积模型为____,在该晶胞中铬原子的配位数为_____。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为___,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是___g·cm-3(列出计算表达式)。
【答案】A AsF3<AsCl3<AsBr3 H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中O原子上的电子向Se偏移的程度大,更容易电离出H+ 三角锥形 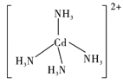
![]() 体心立方堆积 8 WC
体心立方堆积 8 WC 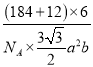
【解析】
(1)结合电离能的变化规律分析解题,注意d轨道全充满的稳定结构,电离能较大;
(2)①AsCl3、AsF3、AsBr3都是分子晶体,根据分子间作用力大小及影响因素与熔点关系分析;非羟基氧越多,酸性越强;
②[Cd(NH3)4]2+中配体是NH3,根据N原子的价电子对数目分析空间构型;Cd2+与NH3通过配位键结合成配合离子;
(3)铬原子核电荷数为24,晶胞的特点是一个Cr原子位于八个Cr原子形成的立方体中心;利用均摊法确定碳化钨的化学式,计算出晶胞的质量和体积,再根据![]() 计算密度。
计算密度。
(1)锌原子的第一电离能大于铜原子第一电离能,有①>③;铜的第二电离能大于锌的第二电离能,有④>②,锌的第二电离能大于第一电离能,②>①,即失去一个电子需要的最低能量由大到小的顺序是④②①③,故答案为A;
(2)①AsBr3、AsCl3、AsF3都是分子晶体,相对分子质量越大,范德华力越大,熔点越高,故熔点由低到高的顺序为AsF3<AsCl3<AsBr3;H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中的O原子的电子向Se偏移程度大,更容易电离出H+,砷酸的酸性弱于硒酸;
②NH3中N原子的价层电子对数目为3+![]() =4,其中有1个孤对电子,N原子为sp3杂化,空间构型是三角锥形;Cd2+与NH3通过配位键结合成配合离子,N原子提供孤对电子,中心离子与4个NH3形成4个配位键,则配离子的结构式为
=4,其中有1个孤对电子,N原子为sp3杂化,空间构型是三角锥形;Cd2+与NH3通过配位键结合成配合离子,N原子提供孤对电子,中心离子与4个NH3形成4个配位键,则配离子的结构式为 ;
;
(3)①基态铬原子的价电子排布式为3d54s1,钼原子与铬原子的核外电子排布特点相同,则基态钼原子的价电子排布式为4d55s1,故价层电子排布图为![]() ;
;
②由铬的晶胞结构可知,一个Cr原子位于八个Cr原子形成的立方体中心,则堆积模型为体心立方堆积,在该晶胞中铬原子的配位数为8;
③晶胞中碳原子数为6个,钨原子数为1+2×![]() +6×2×
+6×2×![]() +6×
+6×![]() =6,则碳化钨的化学式为WC;晶胞的质量为
=6,则碳化钨的化学式为WC;晶胞的质量为![]() g,晶胞的体积为
g,晶胞的体积为![]() cm3,则晶胞密度
cm3,则晶胞密度![]() =
= 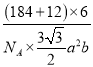 g·cm-3。
g·cm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H=-akJ·mol-1
2CO2(g)+N2(g) H=-akJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=____________,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将__________(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为__________(结果保留两位有效数字)
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为_____________
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是![]()
![]()
A. 向含2molFeBr2的溶液中通入2molCl2:2Fe2++Cl2═2Cl-+2Fe3+
B. 向2molNaAlO2溶液中滴加5molHCl溶于水中:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O
D. 往氢氧化钠溶液中通入少量SO2与水反应OH- + SO2 = HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶体积的关系如图所示,由此确定,原溶液中含有的阳离子是:( )

A.Mg2+、Al3+、Fe2+B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列化学反应,按要求回答问题:
A.(NH4)2SO3![]() 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2![]() 2CO2
2CO2
C.2C+SiO2![]() Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3![]() N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2 F.MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)以上反应中,属于氧化还原反应的是________________(填上述反应的编号);
(2)在反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O中:
MnCl2 + Cl2↑+ 2H2O中:
①氧化剂是___________,氧化产物是________。
②在该反应方程式中用双线桥法表示出电子转移的方向和数目_______________。
③若产生了标准状况下3.36L的氯气,则被氧化的HCl的物质的量为________摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示。下列说法中,不正确的是( )

A. 工业合成氨属于人工固氮
B. 雷电作用下N2与O2发生化学反应
C. 在氮循环过程中不涉及氧化还原反应
D. 含氮无机物与含氮有机化合物可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com