
【题目】现有下列化学反应,按要求回答问题:
A.(NH4)2SO3![]() 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2![]() 2CO2
2CO2
C.2C+SiO2![]() Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3![]() N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2 F.MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)以上反应中,属于氧化还原反应的是________________(填上述反应的编号);
(2)在反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O中:
MnCl2 + Cl2↑+ 2H2O中:
①氧化剂是___________,氧化产物是________。
②在该反应方程式中用双线桥法表示出电子转移的方向和数目_______________。
③若产生了标准状况下3.36L的氯气,则被氧化的HCl的物质的量为________摩尔。
【答案】BCDF MnO2 Cl2 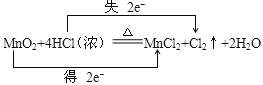 0.3
0.3
【解析】
(1)根据氧化还原反应中存在元素化合价的升降分析判断;
(2)在氧化还原反应中,化合价降低元素所在反应物是氧化剂,化合价升高元素所在反应物是还原剂,化合价升高值=化合价降低值=转移电子数,据此分析解答。
(1)A.(NH4)2SO3 ![]() 2NH3↑+H2O+SO2↑ 各元素化合价不变,所以不属于氧化还原反应,故错误;
2NH3↑+H2O+SO2↑ 各元素化合价不变,所以不属于氧化还原反应,故错误;
B.2CO+O2 ![]() 2CO2中C、O元素化合价变化,属于氧化还原反应,故正确;
2CO2中C、O元素化合价变化,属于氧化还原反应,故正确;
C.2C+SiO2 ![]() Si+2CO↑中C、Si元素化合价变化,属于氧化还原反应,故正确;
Si+2CO↑中C、Si元素化合价变化,属于氧化还原反应,故正确;
D.NH4NO3 ![]() N2O+2H2O中N元素化合价变化,属于氧化还原反应,故正确;
N2O+2H2O中N元素化合价变化,属于氧化还原反应,故正确;
E.CaCO3+CO2+H2O=Ca(HCO3)2各元素化合价不变,所以不属于氧化还原反应,故错误;
F.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O中Mn、Cl元素化合价变化,属于氧化还原反应,故正确;
MnCl2+Cl2↑+2H2O中Mn、Cl元素化合价变化,属于氧化还原反应,故正确;
属于氧化还原反应的有BCDF,故答案为:BCDF;
(2)①在MnO2+4HCl (浓)![]() MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氧化剂为MnO2,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,故答案为:MnO2;Cl2;
MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氧化剂为MnO2,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,故答案为:MnO2;Cl2;
②反应中转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: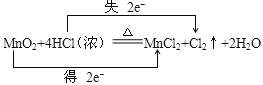 ,故答案为:
,故答案为: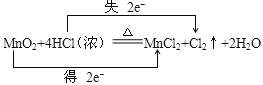 ;
;
③根据氯原子守恒,若产生了标准状况下3.36升的氯气,则被氧化的HCl的物质的量为![]() ×2=0.3mol,故答案为:0.3。
×2=0.3mol,故答案为:0.3。


科目:高中化学 来源: 题型:
【题目】气体A,B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B![]() aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
A.此时,反应混合物总物质的量为1molB.B的转化率40%
C.A的平均反应速率为0.1mol/(L·min)D.a值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是
A. 混合气体中V(N2O4) = 0.336 L
B. 混合气体中n(NO)∶n(NO2) = 1∶5
C. NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5
D. 如采用氨的催化氧化法处理,理论消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是___(填字母)。
A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为__。砷酸的酸性弱于硒酸,从分子结构的角度解释原因____。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为__,画出配离子的结构式__(不考虑立体构型)。
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为___。
②铬的晶胞结构如图A所示,它的堆积模型为____,在该晶胞中铬原子的配位数为_____。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为___,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是___g·cm-3(列出计算表达式)。
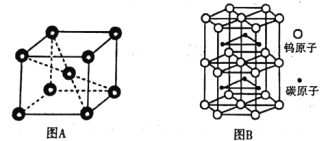
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是____反应,城市射灯在夜空形成五颜六色的光柱,属于___效应。
(3)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3选用的试剂为_____________;
③除去Na2CO3粉末中的NaHCO3,采用的方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】33.6g 含杂质的Na2CO3、NaHCO3均匀混合物平均分成两份,向一份中加入250ml 1.00mol·L-1过量盐酸反应,生成标准状况下3.36L气体。将另一份充分灼烧,干燥后称得固体质量为13.7g。杂质不与酸反应,受热也不分解。求:
(1)原混合物中含有Na2CO3的物质的量。
(2)Na2CO3、NaHCO3的质量比。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化物、氮氧化物、硫氧化物等大气污染物的处理,对缓解环境污染、能源危机具有重要意义。
(1)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
则2NO(g)+2CO(g)![]() N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
(2)氮氧化物和硫氧化物在一定条件下会发生反应,NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
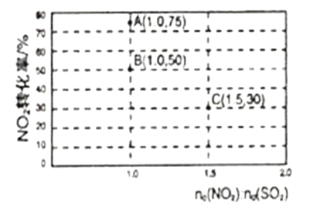
①如果要将图中B点改变为A点,应采取的措施是___;
②若B点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,该时段反应速率υ(NO2)=____mol·L-1·min-1,化学平衡常数K=___;
③图中B、C两点对应的实验温度分别为TB和TC,通过计算判断TB__TC(填>、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
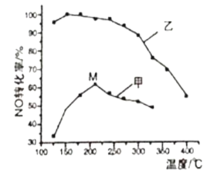
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
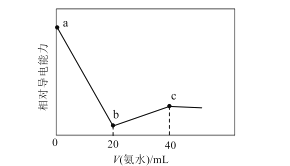
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4L SO3所含的氧原子数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com