
【题目】研究碳氧化物、氮氧化物、硫氧化物等大气污染物的处理,对缓解环境污染、能源危机具有重要意义。
(1)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
则2NO(g)+2CO(g)![]() N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
(2)氮氧化物和硫氧化物在一定条件下会发生反应,NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
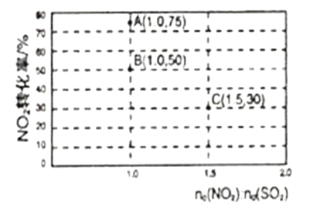
①如果要将图中B点改变为A点,应采取的措施是___;
②若B点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,该时段反应速率υ(NO2)=____mol·L-1·min-1,化学平衡常数K=___;
③图中B、C两点对应的实验温度分别为TB和TC,通过计算判断TB__TC(填>、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
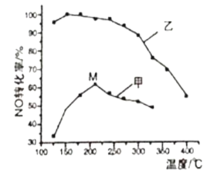
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
【答案】-744.9 降低温度 ![]() 1 < 乙 乙的催化活性高(或乙的催化效率高) 一定不是 催化剂活性降低(或副反应增多)
1 < 乙 乙的催化活性高(或乙的催化效率高) 一定不是 催化剂活性降低(或副反应增多)
【解析】
(1)根据盖斯定律计算ΔH;
(2)①如果要将图中B点的平衡状态改变为A点的平衡状态,平衡转化率增大,平衡正向进行;
②根据反应速率![]() 、
、 计算即可;
计算即可;
③图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,C点二氧化氮转化率30%,计算B、C点对应反应的平衡常数判断反应温度高低;
(3)①根据图象,催化剂在低温下对NO转化率的影响分析;
②使用不同催化剂、温度相同时平衡转化率应相等;甲催化剂随温度升高NO转化率先增大后减小,高于210℃时,NO转化率降低是催化剂活性降低;
(1)①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1;
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1;
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1;
③CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1;
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1;
根据盖斯定律,将![]() ×(③-②+①×2)得:2NO(g)+2CO(g)
×(③-②+①×2)得:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-744.9 kJ·mol-1;故答案为:-744.9;
N2(g)+2CO2(g) ΔH=-744.9 kJ·mol-1;故答案为:-744.9;
(2)①如果要将图中B点的平衡状态改变为A点的平衡状态,平衡转化率增大,平衡正向进行,正反应为放热反应,降低温度,平衡正向移动,转化率增大,故答案为:降低温度;
②B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0molL-1,c(NO2)=c0 molL-1,根据三段式:
NO2 (g) + SO2 (g) SO3 (g) + NO (g)
起始量(mol/L) c0 c0 00
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
![]() ;
;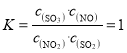 ,故答案为:
,故答案为:![]() ;;
;;
③NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,反应为放热反应,图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0molL-1,c(NO2)=c0 molL-1,根据三段式:
SO3(g)+NO(g) ΔH<0,反应为放热反应,图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0molL-1,c(NO2)=c0 molL-1,根据三段式:
NO2 (g) + SO2 (g) SO3 (g) + NO (g)
起始量(mol/L) c0 c0 00
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
B点平衡常数K(B)=1,
C点二氧化氮转化率30%,n(NO2):n(SO2)=1.5,SO2(g)的起始浓度为c0molL-1,c(NO2)=1.5c0mol/L,根据三段式:
NO2 (g) + SO2 (g) SO3 (g) + NO (g)
起始量(mol/L)1.5c0 c0 00
变化量(mol/L)0.45c0 0.45c0 0.45c0 0.45c0
平衡量(mol/L)1.05c0 0.55c0 0.45c0 0.45c0
平衡常数K(C)=0.35;
平衡常数:B点大于C点,说明反应温度TB<TC,故答案为:<;
(3)①结合图象中曲线变化可知,低温下使用催化剂乙在相同时间内NO的转化率大,使用催化剂乙反应速率快,工业上选择催化剂乙,
故答案为:乙;乙的催化活性高(或乙的催化效率高);
②M点NO的转化率小于相同温度下使用催化剂乙时NO的转化率,则图中M点(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率;使用甲催化剂随温度升高NO转化率先增大后减小,高于210℃时,NO转化率降低是催化剂活性降低或副反应增多,故答案为:一定不是;催化剂活性降低(副反应增多);


科目:高中化学 来源: 题型:
【题目】![]() 是阿伏伽德罗常数的值,下列说法正确的是( )
是阿伏伽德罗常数的值,下列说法正确的是( )
A.23 g Na在氧气中充分燃烧生成![]() ,转移电子数为2
,转移电子数为2![]()
B.![]() 的NaOH溶液中,含有
的NaOH溶液中,含有![]() 的数日为0.01
的数日为0.01![]()
C.电子数为![]() 的
的![]() 分子的质量为1.6g
分子的质量为1.6g
D.标准状况下,3.36 L的![]() 中含有氧原子的数目为0.45
中含有氧原子的数目为0.45![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是![]()
![]()
A. 向含2molFeBr2的溶液中通入2molCl2:2Fe2++Cl2═2Cl-+2Fe3+
B. 向2molNaAlO2溶液中滴加5molHCl溶于水中:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O
D. 往氢氧化钠溶液中通入少量SO2与水反应OH- + SO2 = HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列化学反应,按要求回答问题:
A.(NH4)2SO3![]() 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2![]() 2CO2
2CO2
C.2C+SiO2![]() Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3![]() N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2 F.MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)以上反应中,属于氧化还原反应的是________________(填上述反应的编号);
(2)在反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O中:
MnCl2 + Cl2↑+ 2H2O中:
①氧化剂是___________,氧化产物是________。
②在该反应方程式中用双线桥法表示出电子转移的方向和数目_______________。
③若产生了标准状况下3.36L的氯气,则被氧化的HCl的物质的量为________摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是

A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D.图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示。下列说法中,不正确的是( )

A. 工业合成氨属于人工固氮
B. 雷电作用下N2与O2发生化学反应
C. 在氮循环过程中不涉及氧化还原反应
D. 含氮无机物与含氮有机化合物可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.36 g H2O的物质的量为1 mol
B.常温常压下,1mol Cl2的体积是22.4 L
C.0.5mol·L-1NaCl溶液中含有0.5mol Na+
D.1molCO2中含有的分子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的镁-氮二次电池,其装置如图所示,下列说法不正确的是( )
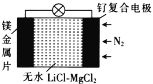
A.固氮时,电池的总反应为3Mg+N2=Mg3N2
B.脱氮时,钌复合电极的电极反应式为Mg3N2-6e-=3Mg2++N2
C.固氮时,外电路中电子由钌复合电极流向镁电极
D.当无水LiCl—MgCl2混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 +3Cl2 +10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式__________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:___________。
(4)工业上制漂白粉的化学方程式为_______________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是______。
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_____________________。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com