
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是

A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D.图中反应过程中只有H—S键的断裂,没有H—S键的形成
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
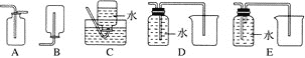
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. AgNO3+NaCl===AgCl↓+NaNO3 B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. 2F2+2H2O===4HF+O2 D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是____反应,城市射灯在夜空形成五颜六色的光柱,属于___效应。
(3)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3选用的试剂为_____________;
③除去Na2CO3粉末中的NaHCO3,采用的方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g·cm-3)配制250mL0.4mol·L-1稀硫酸,有以下实验仪器供选:
A.10mL量筒 B.托盘天平 C.玻璃棒 D.250mL容量瓶 E.500mL容量瓶 F.胶头滴管 G.烧杯
(1)需量取浓硫酸的体积为___mL。
(2)实验时不可选用的仪器有(填序号)___。
(3)配制过程中,下列情况会使配制结果偏高的是___(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配制过程中,实验操作步骤为:___
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用__加蒸馏水,使溶液凹液面恰好与刻度线相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化物、氮氧化物、硫氧化物等大气污染物的处理,对缓解环境污染、能源危机具有重要意义。
(1)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
则2NO(g)+2CO(g)![]() N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
(2)氮氧化物和硫氧化物在一定条件下会发生反应,NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
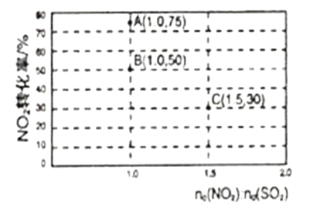
①如果要将图中B点改变为A点,应采取的措施是___;
②若B点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,该时段反应速率υ(NO2)=____mol·L-1·min-1,化学平衡常数K=___;
③图中B、C两点对应的实验温度分别为TB和TC,通过计算判断TB__TC(填>、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
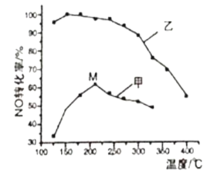
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用蒈烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如图。
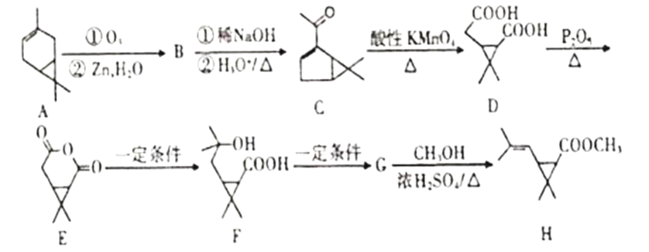
已知①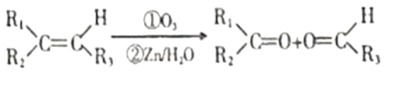
②R1CHO+R2CH2CHO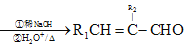 +H2O
+H2O
(1)A的分子式为___。
(2)B的结构简式___。
(3)C中含氧官能团名称为___。
(4)由D生成E,F生成G的反应类型分别是____和_____。
(5)写出由G生成H的化学方程式为____。
(6)满足下列条件D的同分异构体有___种。(不考虑立体异构)
①1molD与碳酸氢钠溶液反应生成标准状况下22.4LCO2气体;
②D分子与稀硫酸共热可水解生成异丙醇;
③该化合物能使溴水褪色。
(7)写出以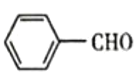 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备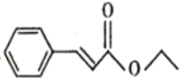 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
燃放烟花爆竹是我国的传统习俗,烟花爆竹的主要成分有黑火药、特效药剂等。

黑火药由硝酸钾(KNO3)、硫黄(S)和木炭组成,
燃烧时,瞬间产生大量气体,同时释放大量热,在有限的空间里,气体受热迅速膨胀引起爆炸。特效药剂常含一些金属元素,燃烧时会产生五彩缤纷的火焰。(如右图所示)
下表为几种金属元素的化合物燃烧时的火焰颜色:
所含金属元素 | 钠 | 钙 | 钡 | 铯 |
火焰颜色 | 黄 | 砖红色 | 黄绿 | 蓝 |
然而,传统的烟花爆竹不仅会污染环境,也会造成各种伤残及火灾事故。为了改善传统烟花爆竹的不足,又能为人们的佳节祝兴,电子鞭炮应运而生。目前,常见的电子鞭炮有三种形式。
第一,雷电式仿真电子鞭炮,不仅能发出普通鞭炮的模拟声,而且还能发出闪光,以假乱真。无火药、无污染,不会发生伤残及火灾事故。能重复使用,大大减少经济支出。其局限性是需要使用家用电源,不方便移动。
第二,电子鞭炮机,是一种使用煤气和氧气混合气体作为燃料的设备,声响大,与火药鞭炮无异,但缺陷是点燃混合气体时存在一定的安全隐患。
第三,录音鞭炮,通过音频解码播放存储于芯片中的鞭炮录音,声音与功率大小有关。这种鞭炮的优点是纯电能、可移动、造价低廉。缺点是仿真和氛围感度稍差。
新型电子鞭炮正在不断地被研发出来,更好地促进民俗与科技的融合。
依据上文,回答问题:
(1)若燃放烟花的火焰呈现黄绿色,则烟花中可能含有______元素。
(2)雷电式仿真电子鞭炮的优点有______(填序号)。
A.无火药、无污染
B.不会发生伤残及火灾事故
C.能重复使用,减少经济支出
(3)判断下列说法是否正确(填“对”或“错”)。
①燃放烟花爆竹时产生不同颜色的火焰,是因为药剂中含有不同的金属元素。______
②燃放烟花爆竹后会闻到刺激性的气味,是因为生成了二氧化碳。______
③电子鞭炮机在点燃混合气体时存在一定的安全隐患。______
④录音鞭炮的声音大小与功率无关。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,不同温度下发生反应:2A(g)![]() 2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
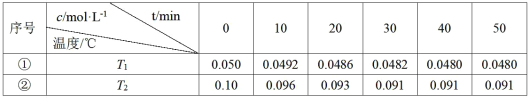
下列说法不正确的是( )
A.实验的温度:T2>T1
B.实验①前20min的平均反应速率v(C)=3.5×10-5molL-1min-1
C.实验②比实验①提前10min达到平衡
D.实验②中A的平衡转化率为9%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com