
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
【答案】Na2O2 黄色 蓝色钴玻璃 白色沉淀迅速变成灰绿色,最终变成红褐色沉淀 2MgO+C+2Cl2![]() 2MgCl2+CO2 NaCl、NaClO、Na2CO3(只写一种)
2MgCl2+CO2 NaCl、NaClO、Na2CO3(只写一种)
【解析】
常见化合物中,过氧化钠为淡黄色粉末;钠的焰色为黄色,透过蓝色钴玻璃观察钾的焰色为紫色;氢氧化亚铁易被空气中的氧气氧化为红褐色氢氧化铁;根据元素守恒,氧化镁、碳粉、氯气反应生成氯化镁、二氧化碳,尾气中含有二氧化碳和氯气,氯气被氢氧化钠吸收生成氯化钠、次氯酸钠,二氧化碳被氢氧化钠吸收生成碳酸钠和水。
(1)过氧化钠是淡黄色粉末,Na、Fe、Cl的常见化合物中,呈淡黄色的是Na2O2。
(2)焰色反应的实验中,Na元素的焰色为黄色,透过蓝色钴玻璃观察K元素的焰色为紫色。
(3)氢氧化亚铁易被空气中的氧气氧化为红褐色氢氧化铁,发生的现象是白色沉淀迅速变成灰绿色,最终变成红褐色沉淀。
(4)根据元素守恒,氧化镁、碳粉、氯气反应生成氯化镁、二氧化碳,反应的化学方程式为2MgO+C+2Cl2![]() 2MgCl2+CO2。尾气中含有二氧化碳和氯气,用足量NaOH溶液完全吸收,生成的盐为NaCl、NaClO、Na2CO3。
2MgCl2+CO2。尾气中含有二氧化碳和氯气,用足量NaOH溶液完全吸收,生成的盐为NaCl、NaClO、Na2CO3。


科目:高中化学 来源: 题型:
【题目】某酸在水溶液中,四种微粒的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列说法正确的是
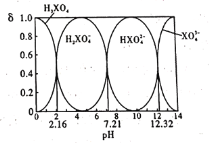
A.H3XO4为三元弱酸,NaH2XO4溶液呈碱性
B.-lgKa3=12.32
C.向0.1 mol/L的Na3XO4溶液中滴加几滴浓KOH溶液,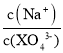 的值变大
的值变大
D.0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
查看答案和解析>>
科目:高中化学 来源: 题型:
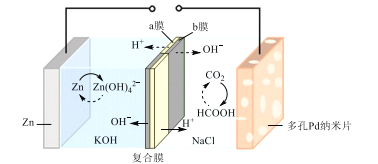
【题目】CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
下列叙述错误的是( )
A.Fe*是反应的催化剂
B.两步反应的ΔH均小于0
C.第一步反应比第二步反应快
D.总反应为CO+N2O=N2+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mlNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
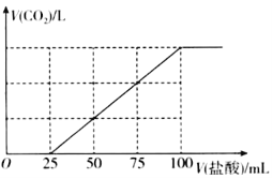
A.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=1:1
B.通入CO2在标准状况下的体积为448mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:3
D.原NaOH溶液的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mlNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
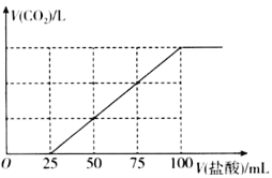
A.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=1:1
B.通入CO2在标准状况下的体积为448mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:3
D.原NaOH溶液的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于东莨菪内酯(![]() )的说法,不正确的是( )
)的说法,不正确的是( )
A.该物质中含有三种含氧官能团
B.该物质能发生氧化、取代、加成反应
C.0.1mol该物质与足量浓溴水反应,最多可消耗0.3molBr2
D.0.1mol该物质与足量NaOH溶液反应,最多可消耗0.3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.lmolL-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示:下列说法不正确的是( )
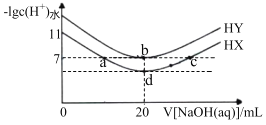
A.a、b、c三点溶液均显中性
B.a点溶液,c(Na+)=c(X-)>c(H+)=c(OH-)
C.b点溶液中的离子总浓度大于d点溶液
D.常温下,Ka(HX)≈10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含铜的铁粉制备 FeCl3的流程如下:
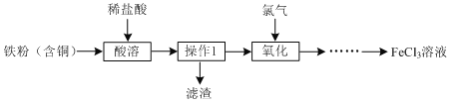
(1)为加快酸溶速率,可采取的措施有______(回答一点即可)。
(2)酸溶后检验所得溶液是否含有Fe3+的方法为______。
(3)操作1的名称______。
(4)氧化过程中发生反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com