
【题目】实验室用含铜的铁粉制备 FeCl3的流程如下:
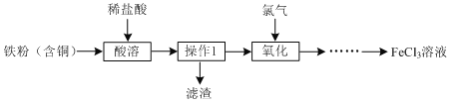
(1)为加快酸溶速率,可采取的措施有______(回答一点即可)。
(2)酸溶后检验所得溶液是否含有Fe3+的方法为______。
(3)操作1的名称______。
(4)氧化过程中发生反应的离子方程式为______。
【答案】适当增加盐酸浓度(适当升高温度、搅拌等) 取少许样品,滴加KSCN溶液,若溶液不变红色,则不含Fe3+;若溶液变为红色,则含有Fe3+ 过滤 2Fe2++Cl2=2Fe3++2Cl-
【解析】
(1)为加快酸溶速率,可采取的措施有增大浓度、升高温度、搅拌等,答案为:适当增加盐酸浓度(适当升高温度、搅拌等)。
(2)酸溶后检验所得溶液是否含有Fe3+,可通过滴加硫氰化钾的方法。答案为: 取少许样品,滴加KSCN溶液,若溶液不变红色,则不含Fe3+;若溶液变为红色,则含有Fe3+。
(3)操作1为固液的分离操作,应为过滤。答案为过滤。
(4)氯气氧化氯化亚铁,化学方程式为:Cl2+2FeCl2=2FeCl3。
答案为:2Fe2++Cl2=2Fe3++2Cl-


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究SO2与Fe(NO3)3稀溶液反应的情况,实验装置如图:
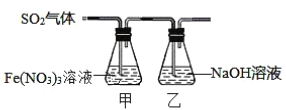
请回答:
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式___。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,W原子是同周期元素中原子半径最小的主族元素。已知A、B、C、D、E为上述四种元素中的两种或三种所组成的5种化合物间的转化关系如右图所示。A的相对分子质量为28,B分子中含有18个电子。下列有关说法错误的是( )

A.由W、Z、X三种元素组成的化合物一定是强酸
B.E能与金属钠反应产生气体
C.化合物D中含有极性键
D.最高价氧化物对应的水化物的酸性W最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
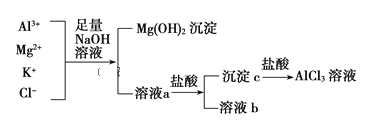
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)在溶液a中加入盐酸时需控制盐酸的量,为什么?___________。为此,改进方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年度诺贝尔化学奖授予美国得州大学奥斯汀分校JohnB.Goodenough教授等人,以表彰其在锂离子电池的发展方面作出的突出贡献。研究表明:Li-Cu4O(PO4)2电池的正极的活性物质Cu4O(PO4)2制备的原理为:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。请回答:
(1)在周期表中,与Li的化学性质最相似的邻族元素在周期表中位置是__。
(2)Cu4O(PO4)2中Cu2+基态电子排布式为__,PO43-的空间构型是___。
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中含有的σ键与π键的数目比为__。
(4)(NH4)2SO4中电负性最大的元素是__。所含化学键的类型有__。
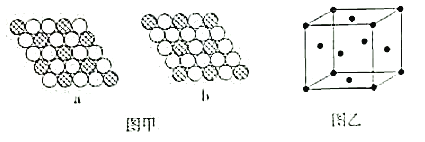
(5)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
①每个冰晶胞平均占有__个水分子,冰的熔点远低于金刚石熔点的原因是__。
②在气相中NH3易与H2O通过氢键以水合物形式存在。试写出水合物NH3·H2O的结构式:__。
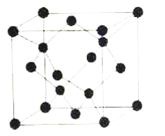
(6)如图甲所示为二维平面晶体示意图。其中表示CuCl2的晶体结构的是___(填“a”或“b”)。金属铜的晶胞如图乙所示,铜原子的配位数是__。若此晶胞立方体的边长为apm,金属铜的密度为ρg·cm-3,则阿伏加德罗常数可表示为___mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
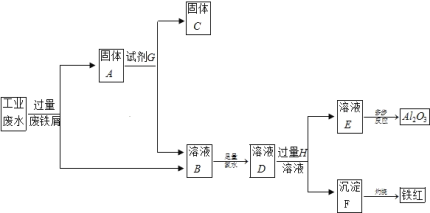
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了Fe2O3、Al2O3和金属Cu。
请回答:
(1)固体A的成分是____________(用化学式表示)。
(2)溶液B→沉淀F的现象是_______________,用化学方程式表示沉淀产生此现象的原理_______。
(3)写出下列反应的离子方程式:反应①中Fe3+发生的反应:_____________,D→E:__________。
(4)小明认为由溶液B→溶液D的过程并不符合绿色化学,所以将氯水换成了H2O2溶液,在该转化过程中若转移2mol 电子,则消耗质量分数为30%的H2O2溶液的质量为________g(精确到0.1g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.乙醇、乙二醇、丙三醇互为同系物
B.1mol甲基![]() 所含的电子数约为10×6.02×
所含的电子数约为10×6.02×![]()
C.14g分子式为![]() 的链烃中含有的C=C的数目一定为
的链烃中含有的C=C的数目一定为![]()
D.同分异构体间具有完全相同的物理性质和化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110 ℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:
Ⅰ.草酸合铁酸钾晶体的制备
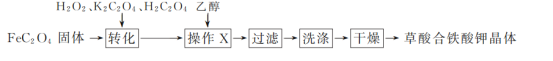
(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:_________________________。
(2)“操作X”中加入乙醇的目的是_______________________。
Ⅱ. 草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量________(填“偏大”“偏小”或“不变”)。
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。 ________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com