
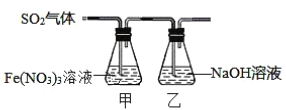
【题目】某兴趣小组为探究SO2与Fe(NO3)3稀溶液反应的情况,实验装置如图:
请回答:
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式___。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子___。
【答案】3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色变浅),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+。)
【解析】
向硝酸铁中通入SO2,SO2会先和Fe3+反应生成Fe2+,溶液由黄色变成浅绿色,随后溶液中的硝酸根、氢离子和Fe2+反应生成Fe3+,溶液由浅绿色变成黄色;反应中未参加反应的SO2会被乙中NaOH吸收。
(1)溶液由浅绿色变成黄色的过程是Fe2+被氧化成Fe3+的过程,相应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)反应结束后溶液中的金属阳离子可能为Fe3+、Fe2+,利用Fe3+、Fe2+的检验方法,取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色变浅),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+。)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )
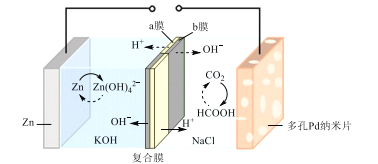
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于东莨菪内酯(![]() )的说法,不正确的是( )
)的说法,不正确的是( )
A.该物质中含有三种含氧官能团
B.该物质能发生氧化、取代、加成反应
C.0.1mol该物质与足量浓溴水反应,最多可消耗0.3molBr2
D.0.1mol该物质与足量NaOH溶液反应,最多可消耗0.3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.lmolL-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示:下列说法不正确的是( )
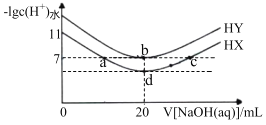
A.a、b、c三点溶液均显中性
B.a点溶液,c(Na+)=c(X-)>c(H+)=c(OH-)
C.b点溶液中的离子总浓度大于d点溶液
D.常温下,Ka(HX)≈10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如图所示,室温下D单质为淡黄色固体。
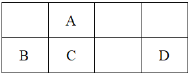
回答下列问题:
(1)C元素在周期表中的位置___,其在自然界中常见的氧化物是___晶体。
(2)A的单质在充足的氧气中燃烧得到的产物的结构式是___,其分子是__分子(“极性”或“非极性”)。
(3)四种元素中可用于航空航天合金材料的制备,其最高价氧化物的水化物的电离方程式为___。
(4)与B同周期最活泼的金属是___,如何证明它比B活泼?(结合有关的方程式进行说明)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.将标况下22.4LCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
B.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为NA
C.某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA
D.常温常压下,20gD218O分子中所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含铜的铁粉制备 FeCl3的流程如下:
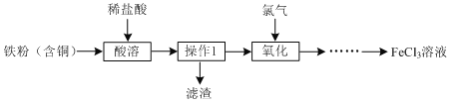
(1)为加快酸溶速率,可采取的措施有______(回答一点即可)。
(2)酸溶后检验所得溶液是否含有Fe3+的方法为______。
(3)操作1的名称______。
(4)氧化过程中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔与甲苯为主要原料,按下列路线合成一种香料W:
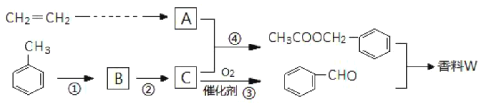
(1)写出实验室制备乙炔的化学方程式___________。
(2)反应①的反应试剂、条件是________,上述①~④反应中,属于取代反应的是________。
(3)写出反应③的化学方程式_____________。
(4)检验反应③是否发生的方法是_______。
(5)写出两种满足下列条件的![]() 同分异构体的结构简式______。
同分异构体的结构简式______。
a.能发生银镜反应 b.苯环上的一溴代物有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com