
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了Fe2O3、Al2O3和金属Cu。
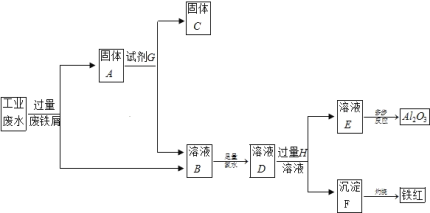
请回答:
(1)固体A的成分是____________(用化学式表示)。
(2)溶液B→沉淀F的现象是_______________,用化学方程式表示沉淀产生此现象的原理_______。
(3)写出下列反应的离子方程式:反应①中Fe3+发生的反应:_____________,D→E:__________。
(4)小明认为由溶液B→溶液D的过程并不符合绿色化学,所以将氯水换成了H2O2溶液,在该转化过程中若转移2mol 电子,则消耗质量分数为30%的H2O2溶液的质量为________g(精确到0.1g)。
【答案】Fe、Cu 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe+2Fe3+=3Fe2+ Al3++4OH-=AlO2-+2H2O 113. 3
【解析】
由废水中含Fe3+、Al3+、Cu2+,加入过量铁粉后,发生2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu,所以固体A为Cu和Fe,溶液B为FeCl2,再加足量的氯水,溶液D为FeCl3溶液,再加过量的氢氧化钠溶液,生成沉淀F为Fe(OH)3,溶液E为NaAlO2,以此解答。
(1)根据流程图中可以知道,完成回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe=3Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,故答案为:Fe、Cu;
(2)过滤所得溶液B中含有Al3+、Fe2+,沉淀F为Fe(OH)3,所以溶液B→沉淀F的现象是先产生白色沉淀迅速变成灰绿色,最终变成红褐色,发生的反应为: 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;答案:白色沉淀迅速变成灰绿色,最终变成红褐色; 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)废水中含Fe3+、Al3+、Cu2+,反应①中Fe3+具有强氧化性,能和铁发生氧化还原反应,发生反应的离子方程式:Fe+2Fe3+=3Fe2+,溶液B中含有Al3+、Fe2+,加氯水后,+2价的铁离子被氯水氧化2Fe2++Cl2=2Fe3++2Cl-,溶液D中含有Al3+、Fe3+,加入过量的NaOH溶液后,会产溶液E的反应为,Al3++4OH-=AlO2-+2H2O;答案:Fe+2Fe3+=3Fe2+;Al3++4OH-=AlO2-+2H2O;
(5)1mol双氧水得到2mol电子,该转化过程中若转移2mol电子,则消耗双氧水是1mol质量是34g,所以消耗质量分数为30%的H2O2溶液的质量为![]() =113.3g;答案:113.3。
=113.3g;答案:113.3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于东莨菪内酯(![]() )的说法,不正确的是( )
)的说法,不正确的是( )
A.该物质中含有三种含氧官能团
B.该物质能发生氧化、取代、加成反应
C.0.1mol该物质与足量浓溴水反应,最多可消耗0.3molBr2
D.0.1mol该物质与足量NaOH溶液反应,最多可消耗0.3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.将标况下22.4LCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
B.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为NA
C.某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA
D.常温常压下,20gD218O分子中所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含铜的铁粉制备 FeCl3的流程如下:
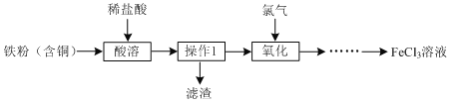
(1)为加快酸溶速率,可采取的措施有______(回答一点即可)。
(2)酸溶后检验所得溶液是否含有Fe3+的方法为______。
(3)操作1的名称______。
(4)氧化过程中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是
A.CH4和C2H4B.C2H2和C2H4C.C2H4和C2H6D.C3H4和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:_____________
互为同分异构体且属于芳香烃的分子的结构简式:_____________
(2)用系统命名法对下列有机物进行命名:
CH3C(CH3)=CHCH3:______________
CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________
(3)某烷烃A蒸气密度是相同状况下氢气密度的64倍,经测定知A分子中共含6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为____________;
②若A是炔烃与氢气加成的产物,A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔与甲苯为主要原料,按下列路线合成一种香料W:
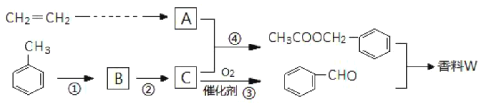
(1)写出实验室制备乙炔的化学方程式___________。
(2)反应①的反应试剂、条件是________,上述①~④反应中,属于取代反应的是________。
(3)写出反应③的化学方程式_____________。
(4)检验反应③是否发生的方法是_______。
(5)写出两种满足下列条件的![]() 同分异构体的结构简式______。
同分异构体的结构简式______。
a.能发生银镜反应 b.苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
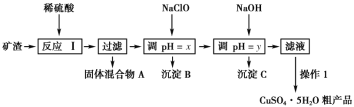
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com