
【题目】向100mlNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
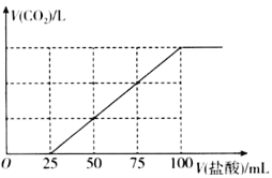
A.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=1:1
B.通入CO2在标准状况下的体积为448mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:3
D.原NaOH溶液的浓度为0.2mol/L
【答案】D
【解析】
根据图像可知,加盐酸的体积0~~25mL时,无气体生成,发生反应为Na2CO3+HCl═NaHCO3+NaCl,加盐酸的体积为25mL~~100 mL时,产生气体,发生的反应为NaHCO3+HCl═CO2↑+NaCl+H2O。
A、根据图像可知,加盐酸的体积0~~25mL时,无气体生成,发生反应为Na2CO3+HCl═NaHCO3+NaCl,消耗盐酸的物质的量为0.2mol/L×0.025L=0.005mol,所以n(Na2CO3)=0.005mol;加入盐酸100mL时恰好完全反应,此时溶质只有氯化钠,n(Na+)=n(Cl-)=0.2mol/L×0.1L=0.02mol,则n(NaHCO3)=0.02mol-0.005mol×2=0.01mol,通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=2:1,故A错误;
B、加盐酸的体积为25mL~~100 mL时,产生气体,发生的反应为NaHCO3+HCl═CO2↑+NaCl+H2O,此反应消耗盐酸的物质的量是0.2mol/L×0.075L=0.015mol,放出CO2在标准状况下的体积为0.015mol ×22.4L/mol=0.336L=336mL,所以氢氧化钠溶液通入CO2在标准状况下的体积为336mL,故B错误;
C、假设NaOH与CO2气体反应所得溶液中只有Na2CO3,则开始阶段发生反应:Na2CO3+HCl=NaHCO3+NaCl,由方程式可知,前后两个阶段消耗盐酸的体积应相等,而实际生成二氧化碳消耗的盐酸体积多,故NaOH与CO2气体反应所得溶液中溶质为Na2CO3、NaHCO3,没有氢氧化钠,故C错误;
D、加入100mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据元素守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.1L×0.2mol/L=0.02mol,所以c(NaOH)=![]() =0.2mol/L,故D正确。
=0.2mol/L,故D正确。


科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
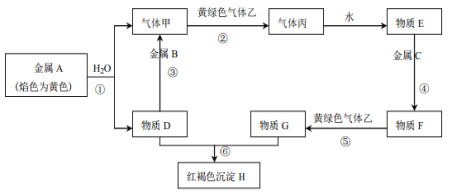
请回答下列问题:
(1)写出 B、乙的化学式:B_______________、乙_______________。
(2)写出下列反应的化学方程式:
反应⑤ ___________________________________________________________;
反应⑥____________________________________________________________。
(3)写出下列反应的离子方程式:
反应①___________________________________________________________;
反应③___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是重要的化工原料
(1)利用图所示装置及药品制取氨气。
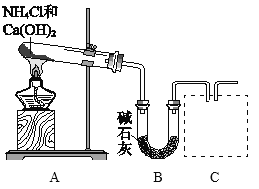
①A中制氨气的化学方程式是________。
②C处是用集气瓶收集氨气的装置,请绘出装置图。________
③证明氨气已集满的操作和现象是________。
(2)氨经催化氧化可制备硝酸,其过程中涉及如下反应。4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
①作为氧化剂的物质是______,氮元素的化合价______(填“升高”或“降低”)。
②若反应中消耗了4 mol NH3,则生成NO的物质的量为______ mol,转移电子的物质的量为______ mol。
(3)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
![]()
请回答:
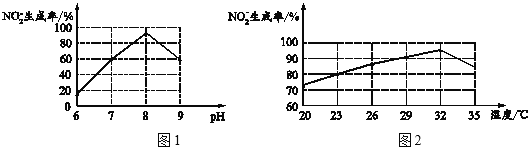
①过程Ⅲ发生化合反应的化学方程式为______。
②根据图1和图2,推断使用亚硝化菌的最佳条件为______。
③利用微生物处理含氮废水的优点为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B.[实验化学]
丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。

(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,上图所示的装置中仪器A的名称是______;蒸馏烧瓶中加入碎瓷片的目的是______。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是____;分离出有机相的操作名称为____。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
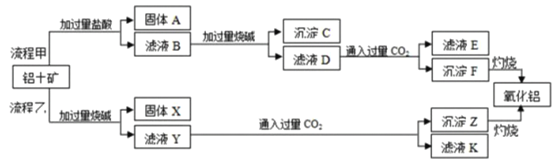
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如图:
请回答下列问题:
(1)固体A的主要成分是___(写名称)。
(2)铝土矿与过量盐酸反应的离子方程式为___、___。
(3)电解熔融氧化铝可制得单质铝,写出该反应化学方程式____;已知氯化铝的熔点更低,工业中为何不用电解熔融氯化铝的方法制备该单质___。
(4)得到的单质铝可以跟强碱溶液放出氢气,每转移6.02×1025个电子,实际上参与反应的氧化剂为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
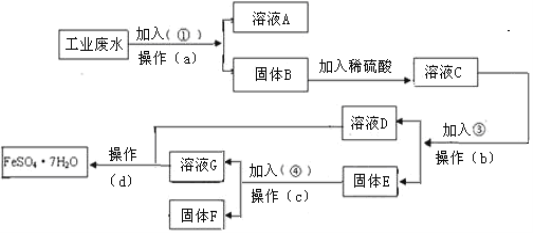
(1)若加入的试剂①为NaOH溶液,加入试剂①的目的___________________。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、玻璃棒、_______。
(3)写出溶液C中加入试剂③发生反应的离子方程式为_______。
(4)写出固体E中加入试剂④发生反应的离子反应方程式为______________。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2:
①MnO2 +4HCl(浓)![]() Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
根据相关信息,回答下列问题:
(1)在反应①中,HCl表现的性质有______、________。
(2)若反应①中有0.1mol的氧化剂被还原,则被氧化的物质的物质的量为____。
(3)将(2)生成的氯气与0.2mol H2完全反应,将产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。
(4)若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2  2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年度诺贝尔化学奖授予美国得州大学奥斯汀分校JohnB.Goodenough教授等人,以表彰其在锂离子电池的发展方面作出的突出贡献。研究表明:Li-Cu4O(PO4)2电池的正极的活性物质Cu4O(PO4)2制备的原理为:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。请回答:
(1)在周期表中,与Li的化学性质最相似的邻族元素在周期表中位置是__。
(2)Cu4O(PO4)2中Cu2+基态电子排布式为__,PO43-的空间构型是___。
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中含有的σ键与π键的数目比为__。
(4)(NH4)2SO4中电负性最大的元素是__。所含化学键的类型有__。
(5)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
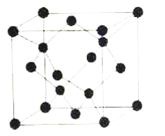
①每个冰晶胞平均占有__个水分子,冰的熔点远低于金刚石熔点的原因是__。
②在气相中NH3易与H2O通过氢键以水合物形式存在。试写出水合物NH3·H2O的结构式:__。
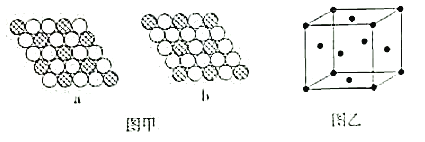
(6)如图甲所示为二维平面晶体示意图。其中表示CuCl2的晶体结构的是___(填“a”或“b”)。金属铜的晶胞如图乙所示,铜原子的配位数是__。若此晶胞立方体的边长为apm,金属铜的密度为ρg·cm-3,则阿伏加德罗常数可表示为___mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com