
����Ŀ��ʵ���ҿ������·�����ȡCl2��
��MnO2 +4HCl��Ũ��![]() Cl2��+ MnCl2+ 2H2O
Cl2��+ MnCl2+ 2H2O
��KClO3��6HCl(Ũ)=3Cl2����KCl��3H2O
��2KMnO4��16HCl(Ũ)=2KCl��2MnCl2��5Cl2����8H2O
���������Ϣ���ش��������⣺
(1)�ڷ�Ӧ���У�HCl���ֵ�������______��________��
(2)����Ӧ������0.1mol������������ԭ�������������ʵ����ʵ���Ϊ____��
(3)��(2)���ɵ�������0.2mol H2��ȫ��Ӧ������������ˮ���100mL��Һ������Һ�����ʵ���Ũ��Ϊ_______��
(4)��Ҫ�Ƶ���ͬ�������������٢ڢ�������Ӧ�е���ת�Ƶ���Ŀ֮��Ϊ____��
(5)��֪��Ӧ4HCl(g)��O2  2Cl2��2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ_______��
2Cl2��2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ_______��
(6)��������NaOH��Ʒ2.50 g(��Ʒ������Na2CO3��ˮ)������50.0 mL 2.00mol/L�����У���ַ�Ӧ����Һ�����ԣ��кͶ����������ȥ40.0 mL 1.00 mol/L��NaOH��Һ�������кͺ����Һ�����յõ����������Ϊ_______��
���𰸡����� ��ԭ�� 0.2 mol 2 mol/L 6��5��6 KMnO4��MnO2��O2 5.85 g
��������
��1������������������̷�Ӧ���ϼ۵ı仯���з�����
��2������������ԭ��Ӧ�м��������з�����
��3�����ݷ�Ӧ����ʽ�Լ����ʵ���Ũ�ȵĶ�����м��㣻
��4�����ݵ�ʧ������Ŀ�غ���з�����
��5������������ǿ���ıȽϽ��з�����
��6������Ԫ���غ���з�����
��1���ڷ�Ӧ����ClԪ�صĻ��ϼ��ɣ�1�ۡ�0�ۣ����ϼ����ߣ�HCl���ֻ�ԭ�ԣ����ݷ�Ӧ����ʽ������MnCl2��Cl�ԣ�1�ۣ���HCl������Ϊ���ԣ�
��2�����ݷ�Ӧ����ʽ����1molMnO2����ԭ������2molHCl����������0.1molMnO2����ԭ����������HCl�����ʵ���Ϊ0.2mol��
��3������(2)�ķ�������0.1molCl2���ɣ���0.2molH2��Ӧ������Cl2��H2=2HCl��������������Ӧ����HCl�����ʵ���Ϊ0.2mol������c=![]() =2mol��L��1��
=2mol��L��1��
��4���õ���ͬ���������������õ���ͬ���ʵ������������õ�1molCl2����Ӧ��ת�Ƶ������ʵ���2mol����Ӧ��ת�Ƶ������ʵ���Ϊ![]() mol����Ӧ��ת�Ƶ������ʵ���Ϊ2mol�����ת�Ƶ�����֮�ȵ���2��
mol����Ӧ��ת�Ƶ������ʵ���Ϊ2mol�����ת�Ƶ�����֮�ȵ���2��![]() ��2=6��5��6��
��2=6��5��6��
��5����ӦԽ�����У���������������Խǿ�����ݷ�Ӧ�������ó�������ǿ��˳����KMnO4��MnO2��O2��
��6�������ķ�Ӧ�У�NaOH��HCl=NaCl��H2O��Na2CO3��2HCl=2NaCl��H2O��CO2����NaOH��HCl=NaCl��H2O�����յõ�������NaCl������Ԫ���غ㣬n(NaCl)=n(Cl��)=n(HCl)=50.0��10��3L��2.00mol��L��1=0.1mol����m(NaCl)=0.1mol��58.5g��mol��1=5.85g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳư�Ϣ����(C6H5COOH)�������ںϳ���ά����֬Ϳ�ϵ�Ҳ����Ϊҩ��������ʹ�ã������������ϸ�����������á�ʵ�������ɼױ��Ʊ��������ʵ�����£�
�������ϣ�
�ٱ�������һԪ�л�����ױ���������ˮ���ܽ�ȣ�0.35g(25��)��2.7g(80��)��5.9g(100��)���ױ��������л��ܼ���������ˮ��
��
��Է������� | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g��cm-3�� | |
������ | 122 | 122.4 | 249 | 1.3 |
�ױ� | 92 | -95 | 110.6 | 0.9 |
ʵ�鲽�裺
��һ������9.2g�ױ��������ữ��KMnO4��Һ��������������ͼ��������ƿ�У����ȱ��ַ�Ӧ����Һ�¶���90����������Ӧ��������Ҫ��ӦΪ5C6H5CH3+6KMnO4+9H2SO4![]() 5C6H5COOH+3K2SO4+4MnSO4+14H2O���Ʊ������в��ϴӷ�ˮ�������ˮ��
5C6H5COOH+3K2SO4+4MnSO4+14H2O���Ʊ������в��ϴӷ�ˮ�������ˮ��
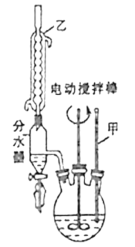
�ڶ���������Ӧ����Һ���ȹ�����Һ��ȴ���������ữ����ͼװ�ó��˵ôֲ�Ʒ���������ֳƼ�ѹ�������ó�����ʹ����ƿ�е�ѹǿ���ʹﵽ��Һ�����Ŀ�ġ���
���������ֲ�Ʒ��ˮϴ��2��3�Σ���������ù���![]() .
.
��ش��������⣺
��1��ͼ1��װ���ҵ�����Ϊ___��
��2����ˮ���������Ƿ����ˮ����ҪĿ����___���жϸ÷�Ӧ������ȫ��ʵ��������___��
��3��ʵ��ڶ����У����ȹ��˵�ԭ����___�����ó��˵��ŵ���____��ֹͣ����ʱ������ͼ2��4���������ָ���ѹ��Ȼ��رճ����ã�װ��3��������____��
��4��������֤���ֲ�Ʒϴ�Ӹɾ��ķ�����___��
��5��������IJ���Ϊ____��
��6����������Լ�����Ʒ������ʵ����֤�����������ᣬ�������Ϊ__��
0.010mol��L-1�ı�������Һ��0.010mol��L-1�ı���������Һ��0.010mol��L-1������������Һ��0.010mol��L-1��������Һ���㷺pH��ֽ�����ȣ���̪��������ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mlNaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2mol/L�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
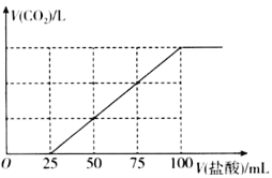
A.ͨ��CO2��������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)=1��1
B.ͨ��CO2�ڱ�״���µ����Ϊ448mL
C.ͨ��CO2��������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)=1��3
D.ԭNaOH��Һ��Ũ��Ϊ0.2mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڵ�Ѫ�쵰��(Hb)����O2��ϣ�HbҲ������CO��ϣ��漰ԭ�����£�
��Ӧ�٣�Hb(aq)+O2(g)![]() HbO2(aq) ��H1<0
HbO2(aq) ��H1<0
��Ӧ�ڣ�Hb(aq)+CO(g)![]() HbCO(aq) ��H2<0
HbCO(aq) ��H2<0
��Ӧ�ۣ�HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) ��H3<0
HbCO(aq)+O2(g) ��H3<0
����˵������ȷ���ǣ� ��
A.��H1>��H2
B.��Ӧ���뷴Ӧ���ڽϵ��¶����Է�����
C.��ƽԭ������ԭ������ѪҺ��c(HbO2)������
D.��CO�ж�����ת����ѹ�����У���Ӧ��ƽ�����ƣ�c(HbO2)����Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������Ϊ20mL��Ũ�Ⱦ�Ϊ0.lmolL-1��HX��Һ��HY��Һ�зֱ�μ�ͬŨ�ȵ�NaOH��Һ����Ӧ����Һ��ˮ�����c(H+)�ĸ�����[-lgc(H+)ˮ]��μ�����������Һ����Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
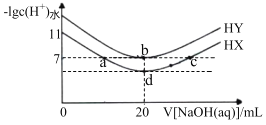
A.a��b��c������Һ��������
B.a����Һ��c(Na+)=c(X-)>c(H��)=c(OH-)
C.b����Һ�е�������Ũ�ȴ���d����Һ
D.�����£�Ka(HX)��10-5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
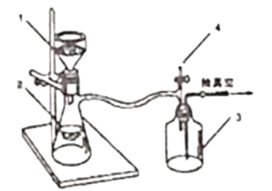
����Ŀ��ij��ѧ��ȤС��Ϊ̽��������������ʣ�����ͼ��ʾװ�ý���ʵ�顣
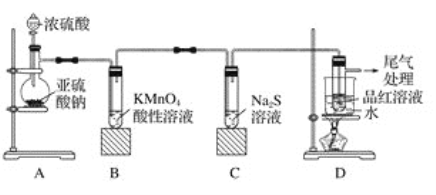
��ش��������⣺
(1)װ��A��ʢ��Ũ���������������__________����Ӧ�Ļ�ѧ����ʽΪ_______________��
(2)װ��B�е�������__________________����Ӧ�����ӷ���ʽΪ_________________��
(3)װ��C�е�������______________��������˵������������е�������_____________��
(4)װ��D��Ŀ����̽������������Ʒ�����õĿ����ԣ�д��ʵ�����������_____________��
(5)β�����շ�����Ӧ�����ӷ���ʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��Կ��淴ӦA(g)+2B(g)![]() 3C(g)�����������У���˵����Ӧ�Ѵﵽƽ����ǣ� ��
3C(g)�����������У���˵����Ӧ�Ѵﵽƽ����ǣ� ��
A. C���ɵ�������C�ֽ���������
B. ��λʱ��������amolA��ͬʱ����3amolC
C. �����ڵ�ѹǿ���ٱ仯
D. �����������ʵ������ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĺϳ�ԭ��Ϊ:N2��g����3H2��g��2NH3��g��H=��92.4kJ��mol-1��500����20MPaʱ����N2��H2����һ���ݻ�Ϊ2L���ܱ������з�����Ӧ����Ӧ�����и����ʵ����ʵ����仯��ͼ���ش���������:
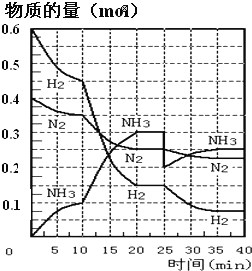
��1��10min����NH3��ʾ��ƽ����Ӧ����Ϊ_________
��2����10��20min�ڣ�NH3Ũ�ȱ仯��ԭ�������_____________
A.���˴���
B.���������
C.�����¶�
D.����NH3���ʵ���
��3����1��ƽ��:ƽ�ⳣ��K1=__________�������ݵı���ʽ������2��ƽ��ʱNH3���������Ϊ_____________��
��4�������������˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fc2O3��TiO2��������ˮ�������з�Ӧ:N2��g����3H2O��l��2NH3+1.5O2��g��H=akJ��mol-1����һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±�:
T/K | 303 | 313 | 323 |
NH3������/(10-6mol) | 4.8 | 5.9 | 6.0 |
�ٴ˺ϳɷ�Ӧ��a______0����S_______0����������������������һ����
����֪N2��g����3H2��g��2NH3��g��H=��92.4kJ��mol-1��2 H2��g���� O2��g��=2H2O��l��H=-571.kJ��mol-1 �����µ�����ˮ��Ӧ���ɰ������������Ȼ�ѧ����ʽΪ_____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵��һ����ȷ����
A.0.5molNO��0.5molO2��ַ�Ӧ�����������0.75NA
B.5.6gFe�ڷ���������ԭ��Ӧʱʧȥ������Ϊ0.2NA
C.1.0L0.1mol/LAl2(SO4)3��Һ����������ĿΪ0.2NA
D.agC2H4��C3H6�������ȫȼ��ʱ����O2�����Ϊ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com