
����Ŀ�����ĺϳ�ԭ��Ϊ:N2��g����3H2��g��2NH3��g��H=��92.4kJ��mol-1��500����20MPaʱ����N2��H2����һ���ݻ�Ϊ2L���ܱ������з�����Ӧ����Ӧ�����и����ʵ����ʵ����仯��ͼ���ش���������:
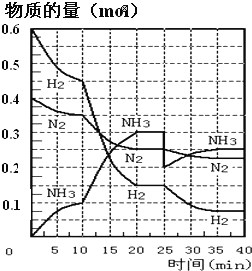
��1��10min����NH3��ʾ��ƽ����Ӧ����Ϊ_________
��2����10��20min�ڣ�NH3Ũ�ȱ仯��ԭ�������_____________
A.���˴���
B.���������
C.�����¶�
D.����NH3���ʵ���
��3����1��ƽ��:ƽ�ⳣ��K1=__________�������ݵı���ʽ������2��ƽ��ʱNH3���������Ϊ_____________��
��4�������������˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fc2O3��TiO2��������ˮ�������з�Ӧ:N2��g����3H2O��l��2NH3+1.5O2��g��H=akJ��mol-1����һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±�:
T/K | 303 | 313 | 323 |
NH3������/(10-6mol) | 4.8 | 5.9 | 6.0 |
�ٴ˺ϳɷ�Ӧ��a______0����S_______0����������������������һ����
����֪N2��g����3H2��g��2NH3��g��H=��92.4kJ��mol-1��2 H2��g���� O2��g��=2H2O��l��H=-571.kJ��mol-1 �����µ�����ˮ��Ӧ���ɰ������������Ȼ�ѧ����ʽΪ_____________________________
���𰸡�0.005mol��L-1.min-1 A ![]() 45.5����0.455 �� �� 2N2(g)��6H2O(l)��4NH3(g) +3O2(g) AH����1530 kJ��mol-1
45.5����0.455 �� �� 2N2(g)��6H2O(l)��4NH3(g) +3O2(g) AH����1530 kJ��mol-1
��������
��1������v=��n��V����t���㣻
��2������ͼ��֪��ƽ��������Ӧ�����ƶ���10minʱ�������ģ������������ʵ��������ӱ�����ͬ��˵��Ϊʹ�ô�����
��3���ﵽƽ��״̬ʱ�����ʵ������䣬�Դ��жϴﵽƽ���ʱ��Σ���ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���2��ƽ��ʱNH3������������ڰ����ĺ���/ƽ��ʱ����������ʵ�����
��4�����ɱ������ݿ�֪�������¶ȣ�NH3����������˵��ƽ��������Ӧ�����ƶ�����Ϸ�Ӧ����ʽ�и����ʵľۼ�״̬���
����֪����N2��g��+3H2��g��![]() 2NH3��g����H=-92.4kJ��mol��1��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ��mol��1�������ø�˹���ɣ�������2-����3�ɵó����µ�����ˮ��Ӧ���ɰ������������Ȼ�ѧ����ʽ��
2NH3��g����H=-92.4kJ��mol��1��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ��mol��1�������ø�˹���ɣ�������2-����3�ɵó����µ�����ˮ��Ӧ���ɰ������������Ȼ�ѧ����ʽ��
��1����Ӧ����v��NH3��=(0.1mol-0)��2L��10min=0.005mol/��L��min����
��2����ͼ���֪��������ʵ����仯���ӣ���10minʱ�仯�������ģ�20min��ƽ��ʱ����n��N2��=0.025mol��4=0.1mol����n��H2��=0.025mol��12=0.3mol����n��NH3��=0.025mol��8=0.2mol�����ʵ����仯֮�ȵ��ڻ�ѧ������֮�ȣ������������ʵ��������ӱ�����ͬ��˵��10min���ܸı��������ʹ�ô�������С����൱������ѹǿ��Ӧ�÷�Ӧ����������ӱ��������¶ȣ�Ӧ�÷�Ӧ���ʼ�С������NH3���ʵ������淴Ӧ�������ӵı�����ֻ��ʹ�ô������ϣ�
��ѡA��
��3����ͼ����Կ���������Ӧ���е�ʱ20-25min�������ʵ������䣬˵����Ӧ�ﵽƽ��״̬����ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���ͼ���֪��20min��ƽ��ʱ��n��N2��=0.025mol��10=0.25mol��n��H2��=0.025mol��6=0.15mol��n��NH3��=0.025mol��12=0.3mol������������ƽ�ⳣ��K=c2(NH3)/c(N2)c3(H2)=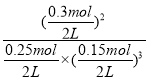 =
=![]() ��
��
��2��ƽ��ʱNH3���������=2.5mol����2.5mol+2.25mol+0.75mol����100%=45.5%��
��4�����ɱ������ݿ�֪�������¶ȣ�NH3����������˵��ƽ��������Ӧ�����ƶ���������ӦӦΪ���ȷ�Ӧ��a��0���ɷ���ʽ��֪��Ӧ������������ʵ������࣬���S��0��
����֪����N2��g��+3H2��g��![]() 2NH3��g����H=-92.4kJ��mol��1��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ��mol��1
2NH3��g����H=-92.4kJ��mol��1��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ��mol��1
�����ø�˹���ɣ�������2-����3�ɵó����µ�����ˮ��Ӧ���ɰ������������Ȼ�ѧ����ʽΪ2N2��g��+6H2O��l��=4NH3��g��+3O2��g����H=2����-92.4kJ��mol��1��-3����-571.6kJ��mol��1��=+1530kJ��mol��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B��[ʵ�黯ѧ]
��Ȳ�������![]() ����һ����Ҫ���л�����ԭ�ϣ��е�Ϊ103~105 �档ʵ�����Ʊ�������Ȳ������ķ�ӦΪ
����һ����Ҫ���л�����ԭ�ϣ��е�Ϊ103~105 �档ʵ�����Ʊ�������Ȳ������ķ�ӦΪ
![]()
ʵ�鲽�����£�
����1���ڷ�Ӧƿ�У�����14 g��Ȳ�ᡢ50 mL�״���2 mLŨ���ᣬ���裬���Ȼ���һ��ʱ�䡣
����2�����������ļ״���װ�ü���ͼ����
����3����ӦҺ��ȴ�������ñ���NaCl��Һ��5%Na2CO3��Һ��ˮϴ�ӡ�������л��ࡣ
����4���л��ྭ��ˮNa2SO4������ˡ����ñ�Ȳ�������

��1������1�У���������״���Ŀ����________��
��2������2�У���ͼ��ʾ��װ��������A��������______��������ƿ�м������Ƭ��Ŀ����______��
��3������3�У���5%Na2CO3��Һϴ�ӣ���Ҫ��ȥ��������____��������л���IJ�������Ϊ____��
��4������4�У�����ʱ������ˮԡ���ȵ�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ������·�����ȡCl2��
��MnO2 +4HCl��Ũ��![]() Cl2��+ MnCl2+ 2H2O
Cl2��+ MnCl2+ 2H2O
��KClO3��6HCl(Ũ)=3Cl2����KCl��3H2O
��2KMnO4��16HCl(Ũ)=2KCl��2MnCl2��5Cl2����8H2O
���������Ϣ���ش��������⣺
(1)�ڷ�Ӧ���У�HCl���ֵ�������______��________��
(2)����Ӧ������0.1mol������������ԭ�������������ʵ����ʵ���Ϊ____��
(3)��(2)���ɵ�������0.2mol H2��ȫ��Ӧ������������ˮ���100mL��Һ������Һ�����ʵ���Ũ��Ϊ_______��
(4)��Ҫ�Ƶ���ͬ�������������٢ڢ�������Ӧ�е���ת�Ƶ���Ŀ֮��Ϊ____��
(5)��֪��Ӧ4HCl(g)��O2  2Cl2��2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ_______��
2Cl2��2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ_______��
(6)��������NaOH��Ʒ2.50 g(��Ʒ������Na2CO3��ˮ)������50.0 mL 2.00mol/L�����У���ַ�Ӧ����Һ�����ԣ��кͶ����������ȥ40.0 mL 1.00 mol/L��NaOH��Һ�������кͺ����Һ�����յõ����������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ:A(g)+B(g) ![]() C(s)+2D(g)����H>0,��ͼ��ʾΪ���淴Ӧ����(v)��ʱ��(t)�Ĺ�ϵ,�����t1ʱ�̸ı���������:�ټ���A;�ڼ������;�ۼ�ѹ;������;������C,����ͼʾ��������(����)��
C(s)+2D(g)����H>0,��ͼ��ʾΪ���淴Ӧ����(v)��ʱ��(t)�Ĺ�ϵ,�����t1ʱ�̸ı���������:�ټ���A;�ڼ������;�ۼ�ѹ;������;������C,����ͼʾ��������(����)��
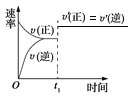
A. �ڢ�B. �٢�C. �ۢ�D. �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ������������������ֶ���������Ԫ�أ�Wԭ����ͬ����Ԫ����ԭ�Ӱ뾶��С������Ԫ�ء���֪A��B��C��D��EΪ��������Ԫ���е����ֻ���������ɵ�5�ֻ�������ת����ϵ����ͼ��ʾ��A����Է�������Ϊ28��B�����к���18�����ӡ������й�˵��������ǣ� ��

A.��W��Z��X����Ԫ����ɵĻ�����һ����ǿ��
B.E��������Ʒ�Ӧ��������
C.������D�к��м��Լ�
D.����������Ӧ��ˮ���������W��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ������ͼ��ʾװ��̽������������������ʡ�
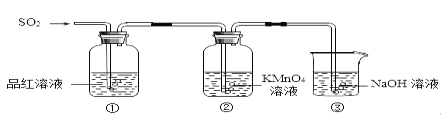
��ش�
(1)ʵ������ͭ��Ũ���Ṳ����ȡ��������Ӧ�Ļ�ѧ����ʽ��_________��
(2)���۲쵽������Һ��ɫ��dzʱ�����е�������_________��
(3)װ�â۵�������________��
(4)�١����е�����˵������������е�������_________��
(5)�����漰�Ļ�ѧ��Ӧ����ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019���ŵ������ѧ�������������ݴ�ѧ��˹͡��УJohnB.Goodenough���ڵ��ˣ��Ա�����������ӵ�صķ�չ����������ͻ�����ס��о�������Li-Cu4O(PO4)2��ص������Ļ�������Cu4O(PO4)2�Ʊ���ԭ��Ϊ��2Na3PO4+4CuSO4+2NH3��H2O=Cu4O(PO4)2��+3Na2SO4+(NH4)2SO4+H2O����ش�
��1�������ڱ��У���Li�Ļ�ѧ���������Ƶ�����Ԫ�������ڱ���λ����__��
��2��Cu4O(PO4)2��Cu2+��̬�����Ų�ʽΪ__��PO43-�Ŀռ乹����___��
��3��������ͭ��Һ�м������KCN�����������[Cu(CN)4]2-����[Cu(CN)4]2-�к��е���������������Ŀ��Ϊ__��
��4��(NH4)2SO4�е縺������Ԫ����__��������ѧ����������__��
��5����������ˮ���ӵĿռ����з�ʽ����ʯ�������ƣ���ͼ��
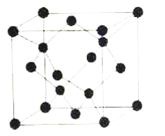
��ÿ��������ƽ��ռ��__��ˮ���ӣ������۵�Զ���ڽ��ʯ�۵��ԭ����__��
����������NH3����H2Oͨ�������ˮ������ʽ���ڡ���д��ˮ����NH3��H2O�Ľṹʽ��__��
��6����ͼ����ʾΪ��άƽ�澧��ʾ��ͼ�����б�ʾCuCl2�ľ���ṹ����___������a������b����������ͭ�ľ�����ͼ����ʾ��ͭԭ�ӵ���λ����__�����˾���������ı߳�Ϊapm������ͭ���ܶ�Ϊ��g��cm-3�����ӵ������ɱ�ʾΪ___mol-1���ú�a�����Ĵ���ʽ��ʾ����
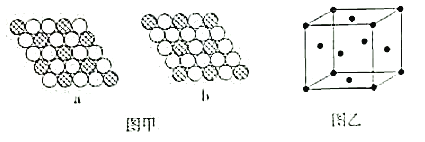
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I������ݹ����ŵIJ�ͬ�������л�����з��ࡣ
��CH3CH2OH ��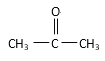 ��CH3CH2Br ��CH3COOCH2CH3 ��
��CH3CH2Br ��CH3COOCH2CH3 ��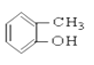 ��
��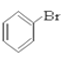 ��CH3CHO ��HCOOH ��
��CH3CHO ��HCOOH ��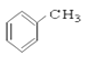 ��
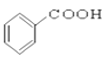
��
��1����������____________
��2��±������______________
��3������__________
��4���ӣ�______________
��5��ȩ��______________
��6��ͪ��_______________
��7�����___________________
��8������______________________
����![]() �ķ���ʽΪ________________��
�ķ���ʽΪ________________��![]() �к��еĹ����ŵ�����Ϊ________________ ��
�к��еĹ����ŵ�����Ϊ________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2H4��N2O4���������������ƽ������ƽ���������Ӧ��2N2H4��l����N2O4��l��=3N2��g����4H2O��g���������й�˵����ȷ���ǣ�������
A.��Ӧÿ����0.3 mol N2��ת�Ƶ��ӵ���ĿΪ1.6��6.02��1023
B.����N2O4���ܱ������д��ڣ�N2O4��g��![]() 2NO2��g������c��N2O4����c��NO2����1��2ʱ���ÿ��淴Ӧ������
2NO2��g������c��N2O4����c��NO2����1��2ʱ���ÿ��淴Ӧ������
C.����N2H4������ȼ�ϵ�ع���ʱ�������缫��ӦʽΪO2��2H2O��4e��=4OH��
D.N2H4��ˮ��Һ�д��ڣ�N2H4��H2O![]() N2H
N2H![]() ��OH������ϡ��Һ�м�ˮϡ�ͣ�
��OH������ϡ��Һ�м�ˮϡ�ͣ� ![]() ��ֵ���
��ֵ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com