
【题目】B.[实验化学]
丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。

(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,上图所示的装置中仪器A的名称是______;蒸馏烧瓶中加入碎瓷片的目的是______。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是____;分离出有机相的操作名称为____。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
【答案】作为溶剂、提高丙炔酸的转化率 (直形)冷凝管 防止暴沸 丙炔酸 分液 丙炔酸甲酯的沸点比水的高
【解析】
B.(1)一般来说,酯化反应为可逆反应,加入过量的甲醇,提高丙炔酸的转化率,丙炔酸溶解于甲醇,甲醇还作为反应的溶剂;
(2)根据装置图,仪器A为直形冷凝管;加热液体时,为防止液体暴沸,需要加入碎瓷片或沸石,因此本题中加入碎瓷片的目的是防止液体暴沸;
(3)丙炔酸甲酯的沸点为103℃-105℃,制备丙炔酸甲酯采用水浴加热,因此反应液中除含有丙炔酸甲酯外,还含有丙炔酸,5%的Na2CO3溶液的作用是除去丙炔酸,降低丙炔酸甲酯在水中的溶解度,使之析出,然后通过分液的方法得到丙炔酸甲酯;
(4)水浴加热提供最高温度为100℃,而丙炔酸甲酯的沸点为103℃-105℃,采用水浴加热,不能达到丙炔酸甲酯的沸点,因此采用直接加热蒸馏。


科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:


已知以下信息:

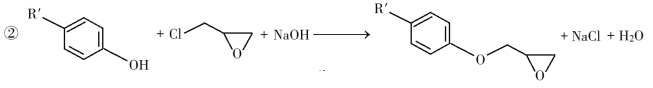
 回答下列问题:
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为__________、__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、__________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
序号 | A | B | C | D |
实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
选用仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)写出图中实验操作的名称:①_____ ③_____
(2)装置④中所有玻璃仪器的名称:_____,_____
(3)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
从 KCl溶液中获取KCl晶体_____;从海水中提取水_____;分离CaCO3和水_____;分离植物油和水_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )


A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用浓盐酸与二氧化锰固体制备氯气。取0.2mol二氧化锰固体加入200g36%的浓盐酸(过量)中,完全反应。
(1)浓盐酸中溶质的物质的量为多少?_______________
(2)产生的氯气在标准状况下的体积为多少?(不考虑氯气溶于水)____________
(3)在反应后溶液中加入足量的AgNO3溶液,生成的AgCl沉淀的质量是多少克?_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com