
【题目】下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
序号 | A | B | C | D |
实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
选用仪器 |
|
|
|
|
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】T ℃,分别向10 mL浓度均为1 mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度对数(lgc)的关系如图所示。
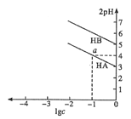
已知:pKa = -lgKa。
下列叙述正确的是
A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA) = 0.1 mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa≈5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示,关于咖啡鞣酸的下列叙述正确的是( )

A. 分子式为C16H20O9
B. 1mol咖啡鞣酸水解时可消耗8mol NaOH
C. 1mol咖啡鞣与H2反应时可消耗4molH2
D. 能发生取代反应和加成反应,但不能消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH![]() 、—CH3、CH
、—CH3、CH![]() 都是重要的有机反应中间体,有关它们的说法正确的是( )
都是重要的有机反应中间体,有关它们的说法正确的是( )
A. 它们互为等电子体,碳原子均采取sp2杂化
B. CH![]() 与NH3、H3O+互为等电子体,立体构型均为正四面体形
与NH3、H3O+互为等电子体,立体构型均为正四面体形
C. CH![]() 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D. CH![]() 与OH-形成的化合物中含有离子键
与OH-形成的化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,反应![]() +H2O
+H2O![]() H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A. 0.2mol·L1氨水:c(NH3·H2O)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 0.2mol·L1NH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() )>c(H2CO3)>c(NH3·H2O)
)>c(H2CO3)>c(NH3·H2O)
C. 0.2mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(![]() )+c(NH3·H2O)=c(H2CO3)+c(
)+c(NH3·H2O)=c(H2CO3)+c(![]() )+c(
)+c(![]() )
)
D. 0.6mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(![]() )+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
)+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
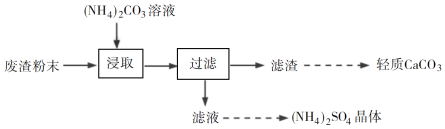
(1)室温下,反应CaSO4(s)+![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)达到平衡,则溶液中
(aq)达到平衡,则溶液中 =________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
=________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为________;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是________;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________。

(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:______[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B.[实验化学]
丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。

(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,上图所示的装置中仪器A的名称是______;蒸馏烧瓶中加入碎瓷片的目的是______。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是____;分离出有机相的操作名称为____。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1mol·L-1HX溶液中逐滴加入0.2mol·L-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是

A. HX为一元强酸,YOH为一元弱碱。
B. M点水的电离程度大于N点水的电离程度
C. N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+)
D. 25℃时pH=4的YX溶液中水电离出的c(H+)=1.0×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) ![]() 1/2N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和提高NO的转化率,采取的正确措施是
1/2N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和提高NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 升高温度同时充入N2
C. 加催化剂同时增大压强 D. 降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com