
【题目】人体内的血红蛋白(Hb)可与O2结合,Hb也可以与CO结合,涉及原理如下:
反应①:Hb(aq)+O2(g)![]() HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0
反应②:Hb(aq)+CO(g)![]() HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0
下列说法不正确的是( )
A.ΔH1>ΔH2
B.反应①与反应②在较低温度能自发进行
C.从平原初到高原,人体血液中c(HbO2)将降低
D.把CO中毒的人转到高压氧仓中,反应①平衡正移,c(HbO2)增大,反应③正移
【答案】D
【解析】
A.根据反应原理和盖斯定律可知,ΔH3=ΔH2-ΔH1,由于ΔH3<0为负值,故ΔH1>ΔH2,A正确;
B. 反应①与反应②中,正反应气体体积减小,故为熵减,ΔS<0,ΔH1和ΔH2均小于0为放热反应,根据吉布斯自由能定义ΔG=ΔH-TΔS,ΔG<0反应才能自发进行,要使ΔG<0,温度T值比较小才能满足,所以,反应要在较低温度能自发进行,B正确;
C. 从平原初到高原,氧气浓度减小,反应①平衡逆移,反应③正移,人体血液中c(HbO2)将降低,C正确;
D. 把CO中毒的人转到高压氧仓中,反应①平衡正移,c(HbO2)增大,而反应③可样直接影响的是氧气浓度,氧气浓度增大,平衡逆移c(HbO2)增大,D不正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】在某温度时将nmol·L-1氨水滴入10mLymol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法不正确的是( )
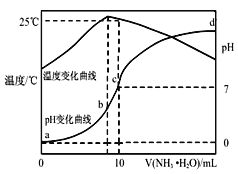
A.y=1.0
B.a点时Kw<1×10-14
C.b点c(NH4+)<c(Cl-)=![]() mol·L-1
mol·L-1
D.25℃时,NH4Cl的水解常数(Kh)可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B.[实验化学]
丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。

(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,上图所示的装置中仪器A的名称是______;蒸馏烧瓶中加入碎瓷片的目的是______。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是____;分离出有机相的操作名称为____。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如图:
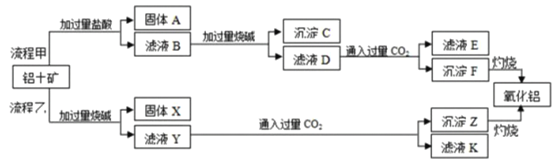
请回答下列问题:
(1)固体A的主要成分是___(写名称)。
(2)铝土矿与过量盐酸反应的离子方程式为___、___。
(3)电解熔融氧化铝可制得单质铝,写出该反应化学方程式____;已知氯化铝的熔点更低,工业中为何不用电解熔融氯化铝的方法制备该单质___。
(4)得到的单质铝可以跟强碱溶液放出氢气,每转移6.02×1025个电子,实际上参与反应的氧化剂为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
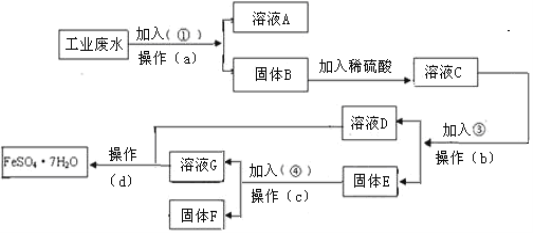
(1)若加入的试剂①为NaOH溶液,加入试剂①的目的___________________。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、玻璃棒、_______。
(3)写出溶液C中加入试剂③发生反应的离子方程式为_______。
(4)写出固体E中加入试剂④发生反应的离子反应方程式为______________。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A转化为C和D分步进行:①A(g)![]() B(g)+2D(g)②B(g)
B(g)+2D(g)②B(g)![]() C(g)+D(g),其反应过程能量如图所示,下列说法正确的是( )
C(g)+D(g),其反应过程能量如图所示,下列说法正确的是( )
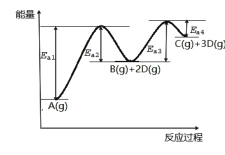
A.1molA(g)的能量低于1molB(g)的能量
B.B(g)![]() C(g)+D(g) ΔH=Ea4-Ea3
C(g)+D(g) ΔH=Ea4-Ea3
C.断裂1molA(g)化学键吸收的热量小于形成1molC(g)和3molD(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2:
①MnO2 +4HCl(浓)![]() Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
根据相关信息,回答下列问题:
(1)在反应①中,HCl表现的性质有______、________。
(2)若反应①中有0.1mol的氧化剂被还原,则被氧化的物质的物质的量为____。
(3)将(2)生成的氯气与0.2mol H2完全反应,将产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。
(4)若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2  2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g) ![]() C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
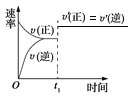
A. ②③B. ①②C. ③④D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)请根据官能团的不同对下列有机物进行分类。
①CH3CH2OH ②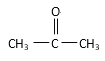 ③CH3CH2Br ④CH3COOCH2CH3 ⑤
③CH3CH2Br ④CH3COOCH2CH3 ⑤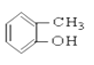 ⑥
⑥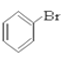 ⑦CH3CHO ⑧HCOOH ⑨
⑦CH3CHO ⑧HCOOH ⑨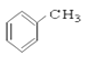 ⑩
⑩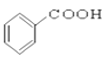
(1)芳香烃:____________
(2)卤代烃:______________
(3)醇:__________
(4)酚:______________
(5)醛:______________
(6)酮:_______________
(7)羧酸:___________________
(8)酯:______________________
(Ⅱ)![]() 的分子式为________________,
的分子式为________________,![]() 中含有的官能团的名称为________________ 。
中含有的官能团的名称为________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com