
【题目】在某温度时将nmol·L-1氨水滴入10mLymol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法不正确的是( )
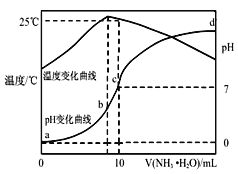
A.y=1.0
B.a点时Kw<1×10-14
C.b点c(NH4+)<c(Cl-)=![]() mol·L-1
mol·L-1
D.25℃时,NH4Cl的水解常数(Kh)可表示为![]()
【答案】C
【解析】
A. a点时pH=0,则c(H+)=1.0mol/L,盐酸为强酸,则y=1.0,故A正确;
B. 水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14,故B正确;
C. b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),原溶液中c(Cl-)= ymol·L-1,b点时滴加氨水体积小于10mL,所以c(Cl-)>![]() mol·L-1故C错误;
mol·L-1故C错误;
D. 根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7molL-1,c(NH4+)=c(Cl-)=![]() mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-
mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-![]() )mol/L,则25℃时NH4Cl水解常数为:K=
)mol/L,则25℃时NH4Cl水解常数为:K=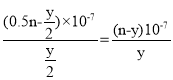 ,故D正确;
,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________。
(4)请配平以下化学方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.标准状况下,1.12L氦气所含的原子数为0.1NA
C.1.8 g NH4+离子中含有的电子数为NA
D.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上可利用多种钼矿制备钼酸钠。镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)是我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。工业上进行选择性还原熔炼可以提取镍铁合金同时得到钼酸钠晶体(Na2MoO4·2H2O),其主要流程如图:
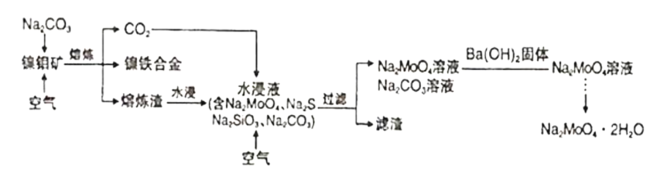
已知:Na2MoO4·2H2O是白色晶体,在水中的溶解度随温度升高而增大。
(1)还原熔炼过程中发生了较多的化学变化请结合题干信息补充完整NiS发生的化学反应方程式,并配平。___
□NiS+□Na2CO3+3C+2O2![]() ___+____+___。
___+____+___。
(2)向水浸液中通人适量CO2和空气,然后过滤,所得滤渣的主要成分为___。
(3)已知过滤所得混合液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1,加入Ba(OH)2固体除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___。
(已知Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8)
(4)从钼酸钠溶液中获取钼酸钠晶体的操作___。
(5)工业上还可以利用如图所示电解装置浸取辉钼矿(主要成分为MoS2)得到Na2MoO4和Na2SO4溶液,制备钼酸钠晶体。
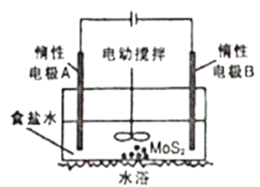
①电解一段时间,电极B附近pH___(填“增大”“减小”或“不变”);
②简述MoO42-生成的原因___。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在二种不同介质中的腐蚀速率实验结果如图所示:
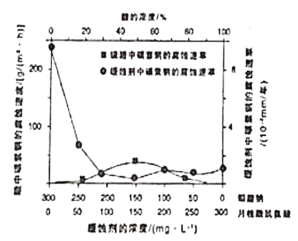
①已知:钼酸钠、月挂酰肌氨酸的相对分子质量分别为M1、M2,要使碳素钢的缓蚀效果最优,钼酸钠和月挂酰肌氨酸的物质的量浓度比应为____;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
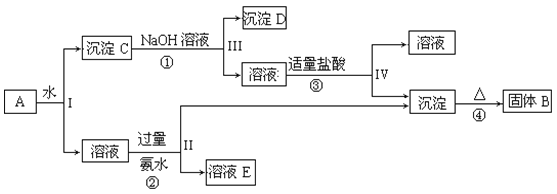
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式。
固体B___;C__;沉淀D___;
(3)写出①、②、③的离子方程式和④的化学方程式。
①___;
②___;
③___;
④____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸又称安息香酸(C6H5COOH),可用于合成纤维、树脂涂料等也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室中由甲苯制备苯甲酸的实验如下:
查阅资料:
①苯甲酸是一元有机弱酸不易被氧化。在水中溶解度:0.35g(25℃)、2.7g(80℃)、5.9g(100℃)。甲苯易溶于有机溶剂,不溶于水。
②
相对分子质量 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) | |
苯甲酸 | 122 | 122.4 | 249 | 1.3 |
甲苯 | 92 | -95 | 110.6 | 0.9 |
实验步骤:
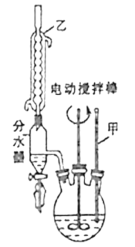
第一步:将9.2g甲苯和硫酸酸化的KMnO4溶液(过量)置于如图的三颈烧瓶中,加热保持反应物溶液温度在90℃左右至反应结束,主要反应为5C6H5CH3+6KMnO4+9H2SO4![]() 5C6H5COOH+3K2SO4+4MnSO4+14H2O,制备过程中不断从分水器分离出水;
5C6H5COOH+3K2SO4+4MnSO4+14H2O,制备过程中不断从分水器分离出水;
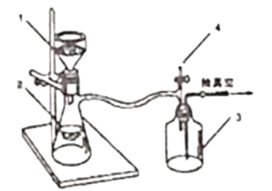
第二步:将反应后混合液趁热过滤滤液冷却后用硫酸酸化用如图装置抽滤得粗产品;(抽滤又称减压过滤利用抽气泵使抽滤瓶中的压强降低达到固液分离的目的。)
第三步:粗产品用水洗涤2到3次,干燥称量得固体![]() .
.
请回答下列问题:
(1)图1中装置乙的名称为___。
(2)分水器的作用是分离出水其主要目的是___,判断该反应进行完全的实验现象是___。
(3)实验第二步中,趁热过滤的原因是___,采用抽滤的优点是____。停止抽滤时先旋开图2中4处的旋塞恢复常压,然后关闭抽气泵,装置3起到的作用是____。
(4)第三步证明粗产品洗涤干净的方法是___。
(5)苯甲酸的产率为____。
(6)结合下列试剂和用品设计最简单实验验证苯甲酸是弱酸,具体操作为__。
0.010mol·L-1的苯甲酸溶液;0.010mol·L-1的苯甲酸钠溶液;0.010mol·L-1的氢氧化钠溶液;0.010mol·L-1的盐酸溶液;广泛pH试纸;甲基橙,酚酞(仪器任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是无色透明有果香气味的液体。实验室制备乙酸正丁酯的反应方程式如下:CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
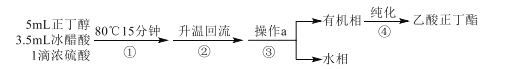
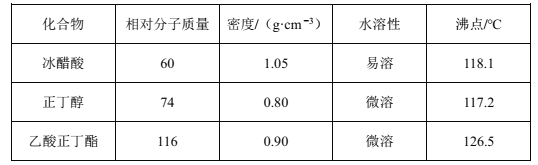
已知:乙酸正丁酯、正丁醇和水组成的三元共沸物的沸点为90.7℃。
反应装置如图所示。在烧瓶中加入反应物和沸石,分水器中加入一定体积水,80℃反应15分钟,然后提高温度使反应处于回流状态,分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。

回答下列问题:
(1)仪器甲的名称是___。步骤①在80℃反应时温度计水银球置于___(填“a”或“b”)处。
(2)使用分水器能提高酯的产率,原因是___(用平衡移动原理解释)。
(3)步骤②观察到___(填标号)现象时,酯化反应已基本完成。
A.当分水器中出现分层 B.分水器中有液体回流至烧瓶
C.分水器水层高度不再变化 D.仪器甲有液体滴落
(4)若反应前分水器中加水不足,会导致___,使产率偏低。
(5)步骤③操作a的名称是___。
(6)步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,分出的产物加入少量无水MgSO4固体,蒸馏,得到乙酸正丁酯4.64g。加入10%Na2CO3溶液的目的是除去___。乙酸正丁酯的产率为___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的血红蛋白(Hb)可与O2结合,Hb也可以与CO结合,涉及原理如下:
反应①:Hb(aq)+O2(g)![]() HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0
反应②:Hb(aq)+CO(g)![]() HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0
下列说法不正确的是( )
A.ΔH1>ΔH2
B.反应①与反应②在较低温度能自发进行
C.从平原初到高原,人体血液中c(HbO2)将降低
D.把CO中毒的人转到高压氧仓中,反应①平衡正移,c(HbO2)增大,反应③正移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com