
【题目】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________。
(4)请配平以下化学方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
【答案】
(1)D;
(2)C;
(3)5H2O2+2MnO![]() +6H+===5O2↑+2Mn2++8H2O
+6H+===5O2↑+2Mn2++8H2O
(4)10 6 4 10 3 2。
【解析】
试题分析:(1)A.Na2O2+2HCl═2NaCl+H2O2中各元素化合价不变,所以不属于氧化还原反应;B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由-1价变为0价,所以氧化银是氧化剂、双氧水是还原剂;C.2H2O2═2H2O+O2↑中O元素由-1价变为0价和-2价,所以双氧水是氧化剂和还原剂;D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由-1价变为-2价,所以双氧水是氧化剂,硫酸铬为还原剂。H2O2仅体现氧化性的反应是D,故选D;
(2)H2O2既体现氧化性又体现还原性的反应是C,故选C;
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
①氧化反应:H2O2-2e-═2H++O2↑,
②还原反应:MnO4-+5e-+8H+═Mn2++4H2O,
①×5+②×2得到:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(4)在反应Al+NaNO3+NaOH=NaAlO2+N2↑+H2O中,铝元素从0价变为+3价,氮从+5价变为0价,根据电子得失守恒可知,Al的系数为10,NaNO3的系数为6,NaAlO2的系数为10,N2的系数为3,根据钠元素守恒可知,NaOH的系数为4,根据氢元素守恒可知,H2O的系数为2,所以反应方程式为10Al+6 NaNO3+4 NaOH = 10NaAlO2+3N2↑+2H2O, 故答案为:10、6、4、10、3、2。


科目:高中化学 来源: 题型:
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O

(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将其序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
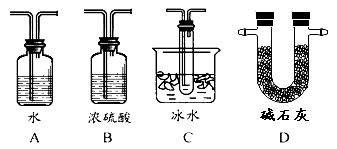
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用12.6gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了4.48g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行如下反应:2X(g) + Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)=Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)=ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA
B.1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA
C.2.0g H218O与D2O的混合物中所含中子数为NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3﹣物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验操作正确的是( )
A. 加热蒸发皿时垫上石棉网
B. 将氢氧化钠固体放入烧杯中称量
C. 在量筒中溶解氯化钠固体
D. 将pH试纸浸入待测液中测定pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各组中的实验步骤和现象,分析正确的一项是
选项 | 实验现象 | 原因分析 |
A | 证明酸性条件下H2 O2氧化性比I2强10.关于下列各装置的叙述正确的是( )A.装置①可用于实验室制备NO气体B.装置②可肜于模拟海水蒸馏 C.装置③可用于探究碳酸氢钠的热稳定性 D.装置④为配制溶液过程中的定容操作 11.下列说法正确的是( ) A.将铁粉加入FeCl3、Cucl2混合溶液中,充分反应后剩余的固体中必有铁 B.CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 C.钠、镁着火时,不可用泡沫灭火器灭火 D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 12.对下列各组中的实验 | 碘化钠溶液 |
B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl、HClO显酸性,使石蕊变红,Cl2具有强氧化性,使褪色 |
C | SO2通入溴水中,溴水褪色 | SO2具有漂白性,使其褪色 |
D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成CO2、SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com