
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
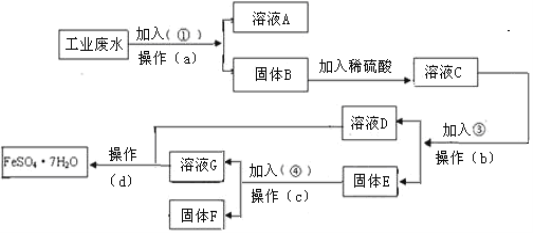
(1)若加入的试剂①为NaOH溶液,加入试剂①的目的___________________。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、玻璃棒、_______。
(3)写出溶液C中加入试剂③发生反应的离子方程式为_______。
(4)写出固体E中加入试剂④发生反应的离子反应方程式为______________。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、______、过滤、洗涤、干燥。
【答案】使Cu2+和Fe2+完全沉淀 漏斗 Fe+ Cu2+=Fe2++ Cu Fe+ 2H+=Fe2++ H2↑ 冷却结晶
【解析】
先加过量碱,过滤得到Cu(OH)2、Fe(OH)2沉淀,滤液是Na2SO4、NaOH,在Cu(OH)2、Fe(OH)2中加入过量稀硫酸,溶液C的成分为CuSO4、FeSO4、H2SO4,然后加入过量的铁,过滤出Fe、Cu,滤液D是FeSO4,在固体E中加过量稀硫酸,过滤出Cu,实现了回收金属铜,滤液是FeSO4和H2SO4,最后溶液合一块,进行蒸发浓缩、冷却结晶、过滤,得到FeSO4·7H2O,以此解答该题。
(1)根据上述分析,加入试剂①为NaOH溶液,其目的是使Cu2+和Fe2+完全沉淀;
(2)过滤用到玻璃仪器是漏斗、玻璃棒、烧杯,因此缺少的仪器是漏斗;
(3)根据上述分析,溶液C中加入过量的Fe单质,发生离子方程式为Fe+Cu2+=Fe2++Cu;
(4)固体E中有Fe和Cu,需要加入过量的稀硫酸,即反应离子方程式为Fe+2H+=Fe2++H2↑;
(5)因为得到FeSO4·7H2O,因此将溶液蒸发浓缩、冷却结晶、过滤、洗涤、低温烘干。


科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上可利用多种钼矿制备钼酸钠。镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)是我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。工业上进行选择性还原熔炼可以提取镍铁合金同时得到钼酸钠晶体(Na2MoO4·2H2O),其主要流程如图:
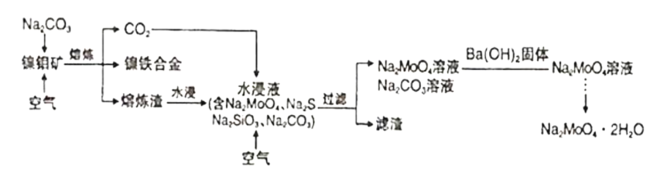
已知:Na2MoO4·2H2O是白色晶体,在水中的溶解度随温度升高而增大。
(1)还原熔炼过程中发生了较多的化学变化请结合题干信息补充完整NiS发生的化学反应方程式,并配平。___
□NiS+□Na2CO3+3C+2O2![]() ___+____+___。
___+____+___。
(2)向水浸液中通人适量CO2和空气,然后过滤,所得滤渣的主要成分为___。
(3)已知过滤所得混合液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1,加入Ba(OH)2固体除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___。
(已知Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8)
(4)从钼酸钠溶液中获取钼酸钠晶体的操作___。
(5)工业上还可以利用如图所示电解装置浸取辉钼矿(主要成分为MoS2)得到Na2MoO4和Na2SO4溶液,制备钼酸钠晶体。
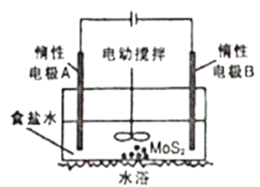
①电解一段时间,电极B附近pH___(填“增大”“减小”或“不变”);
②简述MoO42-生成的原因___。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在二种不同介质中的腐蚀速率实验结果如图所示:
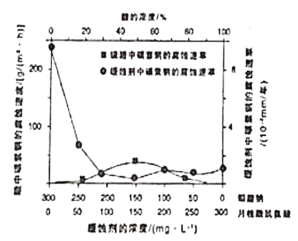
①已知:钼酸钠、月挂酰肌氨酸的相对分子质量分别为M1、M2,要使碳素钢的缓蚀效果最优,钼酸钠和月挂酰肌氨酸的物质的量浓度比应为____;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
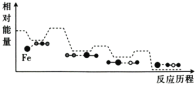
下列叙述错误的是( )
A.Fe*是反应的催化剂
B.两步反应的ΔH均小于0
C.第一步反应比第二步反应快
D.总反应为CO+N2O=N2+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mlNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
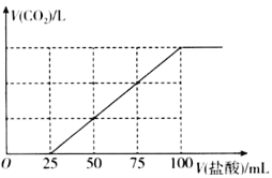
A.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=1:1
B.通入CO2在标准状况下的体积为448mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:3
D.原NaOH溶液的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于东莨菪内酯(![]() )的说法,不正确的是( )
)的说法,不正确的是( )
A.该物质中含有三种含氧官能团
B.该物质能发生氧化、取代、加成反应
C.0.1mol该物质与足量浓溴水反应,最多可消耗0.3molBr2
D.0.1mol该物质与足量NaOH溶液反应,最多可消耗0.3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的血红蛋白(Hb)可与O2结合,Hb也可以与CO结合,涉及原理如下:
反应①:Hb(aq)+O2(g)![]() HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0
反应②:Hb(aq)+CO(g)![]() HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0
下列说法不正确的是( )
A.ΔH1>ΔH2
B.反应①与反应②在较低温度能自发进行
C.从平原初到高原,人体血液中c(HbO2)将降低
D.把CO中毒的人转到高压氧仓中,反应①平衡正移,c(HbO2)增大,反应③正移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.lmolL-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示:下列说法不正确的是( )
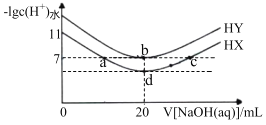
A.a、b、c三点溶液均显中性
B.a点溶液,c(Na+)=c(X-)>c(H+)=c(OH-)
C.b点溶液中的离子总浓度大于d点溶液
D.常温下,Ka(HX)≈10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是
A.CH4和C2H4B.C2H2和C2H4C.C2H4和C2H6D.C3H4和C3H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com