
【题目】下列有关Na2CO3和NaHCO3的叙述中,正确的是( )
A.NaHCO3俗名纯碱,Na2CO3俗名苏打
B.受热时,NaHCO3比Na2CO3容易分解
C.NaHCO3溶液显酸性,Na2CO3溶液显碱性
D.NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同
【答案】B
【解析】
A.Na2CO3俗名为苏打、纯碱;NaHCO3俗名为小苏打,A错误;
B.NaHCO3的热稳定性差,加热会发生分解反应,方程式是:2NaHCO3![]() Na2CO3+CO2↑+H2O,而Na2CO3相对较强,不易分解,B正确;
Na2CO3+CO2↑+H2O,而Na2CO3相对较强,不易分解,B正确;
C.Na2CO3、NaHCO3都是强碱弱酸盐,在溶液中弱酸根离子发生水解反应,使溶液都呈碱性,C错误;
D.NaHCO3和Na2CO3都可以与酸发生反应,方程式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,从反应方程式可知Na2CO3、NaHCO3各1mol产生的CO2的质量相同,D错误;
答案选B。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】铍是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的一种新兴材料。以某地的含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)为原料,生产工业氧化铍的一种工艺流程如图:
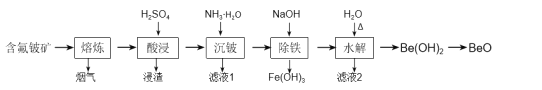
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
(1)“熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为___。
(2)浸渣的主要成分为CaSO4、___。
(3)加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:___、___、___。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为___,然后加适量水稀释进行“水解”,目的是___。
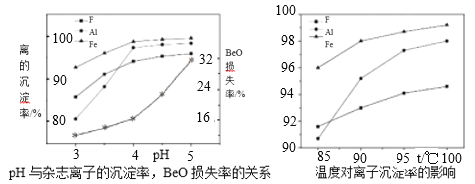
(5)若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH=___,水浴加热温度T=___℃。
(6)氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照《能源发展“十三五”规划》的要求,到2020年,中国煤炭消费总量控制在41亿吨以内,所占比重应减少到58%。推进煤炭清洁高效利用是我国能源发展重要举措之一。![]() 在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述不正确的是( )
在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述不正确的是( )
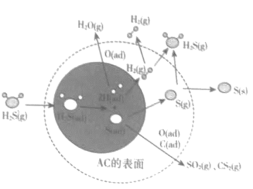
A.图中阴影部分为![]() 的解离过程
的解离过程
B.图中既有O-H键的形成也有O-H键的断裂
C.![]() 在AC表面的去除率与温度有关
在AC表面的去除率与温度有关
D.![]() 在AC表面作用生成的产物有
在AC表面作用生成的产物有![]() 等
等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶夜300ml,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的四种短周期主族元素,常见单质分子
是原子序数依次增大的四种短周期主族元素,常见单质分子![]() 中含有3对共用电子对,由
中含有3对共用电子对,由![]() 、
、![]() 形成的一种气态化合物不能稳定地存在于空气中,
形成的一种气态化合物不能稳定地存在于空气中,![]() 、
、![]() 同周期且
同周期且![]() 的最高正价是
的最高正价是![]() 的7倍。下列说法正确的是( )。
的7倍。下列说法正确的是( )。
A.含氧酸的酸性:![]()
B.简单离子半径:![]()
C.最简单氢化物的沸点:![]()
D.![]() 与
与![]() 形成的化合物中只含有离子键
形成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,并验证乙烯的性质。完成下列填空:
(1)实验室制取乙烯的化学方程式为:________________________________________
(2)可用于制取乙烯的发生装置是____________。(选填编号)
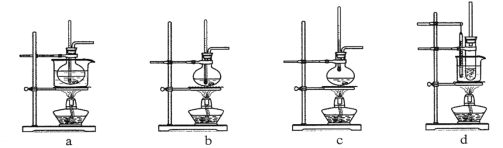
(3)反应液加入碎瓷片的目的是:_______________________。
(4)制得的乙烯中常含有SO2和CO2 ,设计实验证明乙烯能使溴水褪色。(画出装置图)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L氢气中含有2NA个中子
B. 0.1NA个氯化氢分子占有体积为2.24 L
C. 2克金属钙变成钙离子时失去的电子数为0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
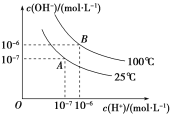
(1)A点水的离子积常数为1×1014,B点水的离子积常数为________________。造成水的离子积常数变化的原因是________________________________________________________________________。
(2)100 ℃时,若向水中滴加盐酸,________(填“能”或“不能”)使体系处于B点状态,原因是____________________________________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×104 mol·L1,则由水电离产生的c(H+)=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com