
【题目】W、X、Y、Z是四种原子序数依次增大的短周期元素,W、X两种元索可组成W2x和W2X2两种常见的无色液体化合物, Y2X2为淡黄色固体化合物,Z的原子序数是X的原子序数的两倍。请回答下列问题:
(1)Z元素的名称是___________ 。
(2)W、X、Y三种元素形成的化合物的电子式_____________
(3)写出Y2X2中所含化学键有:___________。
(4)写出Y2X2和W2X反应的化学方程式:_______________
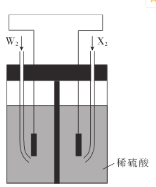
(5)W2和X2是组成某种燃料电池的两种常见物质,如图所示,通人X2的电极是___(填“正极”或“负极”),写出通人W2的电极的电极反应式:________________
【答案】硫 ![]() 离子键和共价键 2Na2O2 + 2H2O=4NaOH + O2↑ 正 H2-2e-=2H+
离子键和共价键 2Na2O2 + 2H2O=4NaOH + O2↑ 正 H2-2e-=2H+
【解析】
W、X两种元素可组成W2X和W2X2两种常见的无色液体化合物,故W为H元素;X为O元素;Y2X2为淡黄色固体化合物,故Y为Na元素;Z的原子序数是X的原子序数的两倍,故Z为S元素,据此进行分析。
W、X两种元素可组成W2X和W2X2两种常见的无色液体化合物,故W为H元素;X为O元素;Y2X2为淡黄色固体化合物,故Y为Na元素;Z的原子序数是X的原子序数的两倍,故Z为S元素;
(1) Z元素的名称是S元素;
(2)W、X、Y三种元素分别为H、O、Na,形成的化合物是NaOH,是离子化合物,其电子式为![]() ;
;
(3) Y2X2为Na2O2,是离子化合物,所含化学键有离子键和共价键;
(4) Y2X2为Na2O2,W2X为H2O,两者反应生成NaOH和O2,反应的化学方程式为2Na2O2 + 2H2O=4NaOH + O2↑;
(5) X2为O2,氢氧燃料电池,负极通氢气,正极通氧气,发生还原反应,故通入O2的电极是正极;W2为H2,通H2的极负极,负极发生氧化反应,故电极反应方程式为H2-2e-=2H+。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO (g)+H2O (g) ![]() CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:
CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:

下列说法正确的是
A.0~5 min 用 CO 表示的平均反应速率为 0.08mol·L1·min1
B.该反应在 10 min 后才达到平衡
C.温度升高至 800℃时,反应平衡常数为 0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2 ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
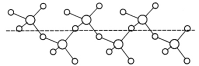
(4)绿矾是一种重要的硫酸盐,其组成可写成[Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42-中的O原子相联结,按图示画出含氢键的水合阴离子:______________。

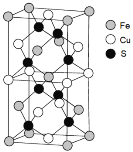
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成F,其合成路线如下图所示。

(1)A分子中官能团的名称是____________,D中官能团的名称是________反应①的反应类型是___________反应。
(2)反应②的化学方程式是___________________________。
反应④的化学方程式是___________________________。
(3)E是常见的高分子材料,合成E的化学方程式是_____________________________。

(4)某同学用如右图所示的实验装置制取少量F。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
① 实验开始时,试管甲中的导管不伸入液面下的原因是______________。
②上述实验中饱和碳酸钠溶液的作用是(填字母) ________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备F的实验中,若用1mol B和1mol D充分反应,__________(能/不能)生成1mol F,原因是 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种用于分离镧系金属的化合物 A,其结构如下图所示。短周期元素 X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述,正确的是

A.化合物 A中,X、Y、Z最外层都达到8电子稳定结构
B.离子半径:Y>Z
C.最简单氢化物的沸点:Z>Y
D.最高价氧化物对应水化物的酸性:Z<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
该反应是____反应(填“吸热反应”或“放热反应”);反应初始至平,A的平均反应速率v(A)=_____。达到平衡后,B的转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)![]() 的系统命名____。
的系统命名____。
(2)2,5-二甲基-2,4-己二烯的结构简式:___。
(3)![]() 的键线式:____。
的键线式:____。
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为____。
(5)有机物二苯甲烷![]() 中,该分子中有__种不同化学环境的H原子。
中,该分子中有__种不同化学环境的H原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com