
【题目】科学家合成出了一种用于分离镧系金属的化合物 A,其结构如下图所示。短周期元素 X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述,正确的是

A.化合物 A中,X、Y、Z最外层都达到8电子稳定结构
B.离子半径:Y>Z
C.最简单氢化物的沸点:Z>Y
D.最高价氧化物对应水化物的酸性:Z<X
【答案】A
【解析】
根据图示A的结构可知,正离子中Z失去一个电子后形成3个共价键,说明Z原子最外层为6个电子,且Z位于第三周期,则Z为S;负离子中Y形成一个共价键,为-1价,不是第三周期元素,且原子序数大于X,应为F(当然不是H,因为正离子已经有H);X得到一个电子形成4个共价键,说明其最外层为3个电子,则X为B元素,据此解答。
根据分析可知,X为B,Y为F,Z为S元素;
A.结合分析可知,化合物A分子中B、F、S元素最外层都达到8电子稳定结构,其中B原子周围形成3个共价键和1个配位刍键,故A正确;
B.电子层越多离子半径越大,则离子半径F-<S2-,即Y<Z,故B错误;
C.在标准状况下,HF为液体,而H2S为气体,则最简单氢化物的沸点:HF>H2S,即Y >Z,故C错误;
D.非金属性越强,最高价含氧酸的酸性越强,非金属性:B<S,则最高价氧化物对应水化物的酸性:H3BO3(弱酸)<H2SO4(强酸),即X<Z,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4、NaOH混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )

A. 0.100 mol·L-1NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
C. P点:c(Na+)+c(H2C2O4)<0.100mol·L-1+c(C2O42-)
D. 该温度下H2C2O4的电离常数Ka2=1×10-4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种原子序数依次增大的短周期元素,W、X两种元索可组成W2x和W2X2两种常见的无色液体化合物, Y2X2为淡黄色固体化合物,Z的原子序数是X的原子序数的两倍。请回答下列问题:
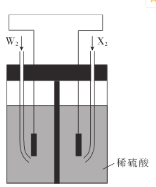
(1)Z元素的名称是___________ 。
(2)W、X、Y三种元素形成的化合物的电子式_____________
(3)写出Y2X2中所含化学键有:___________。
(4)写出Y2X2和W2X反应的化学方程式:_______________
(5)W2和X2是组成某种燃料电池的两种常见物质,如图所示,通人X2的电极是___(填“正极”或“负极”),写出通人W2的电极的电极反应式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
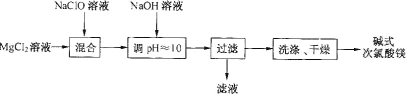
(1)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:_____。
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
①通过计算判断该产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)_____________
②根据你的判断,推测产品中可能含有的杂质,并给出制备过程能减少产品中含有该杂质的措施_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A为一种黄绿色的气体,B为常见的无色液体,H为一种助燃的气体,F为一种气体,它在A中燃烧产生苍白色火焰,E为一种能被磁铁吸引的金属。
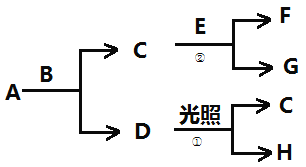
(1)B的化学式为____________。
(2)F的化学式为____________。
(3)写出反应②的化学方程式:_______________________________。
(4)写出反应①的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将 n mol·L-1氨水滴入 10 mL 1.0 mol·L-1盐酸中,溶液 pH 和温度随加入氨水体积变化曲线如图所示。下列有关说法错误的是
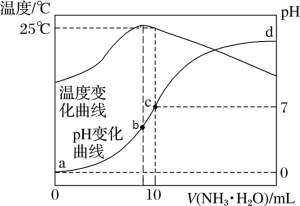
A.c 点存在守恒关系:c(NH4+)=c(Cl-)
B.b 点:c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C.水的电离程度:b > c > a > d
D.25℃时 ,NH4Cl 水解平衡常数为(n-1)×10-7(用 n 表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.铁与盐酸反应:2Fe+6H+==2 Fe3++ H2↑
B.在氯化铝溶液中滴加过量的氨水:Al3++4 OH﹣═ AlO![]() +2 H2O
+2 H2O
C.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH﹣═ Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com